COVID-19 y la microbiota intestinal
Síntesis
Por el Pr. Tao Zuo
Instituto de Investigación de Gastroenterología SYSU, Instituto de Gastroenterología de Guangdong, Sexto Hospital Afiliado de la Universidad Sun Yat-Sen, Guangzhou, China
Espacio para el público general
Encuentra aquí tu espacio dedicado
en_sources_title
en_sources_text_start en_sources_text_end
Capítulos
Acerca de este artículo
Autor
La microbiota intestinal, incluidas las fracciones bacteriana, fúngica y vírica, puebla los intestinos humanos y regula la inmunidad del anfitrión frente a invasiones de patógenos. La gran heterogeneidad en la composición de la microbiota intestinal (MI) en distintas personas puede influir en las respuestas inmunitarias del anfitrión a la infección por SARS-CoV-2, dando lugar a distintos síntomas y evoluciones de la COVID-19. Por otro lado, aunque la infección por SARS-CoV-2 provoca principalmente síntomas respiratorios, también causa una profunda desregulación de la inmunidad general del anfitrión y afecta al aparato digestivo, donde la microbiota intestinal puede verse afectada tanto a corto como a largo plazo. Aquí, vamos a revisar la evidencia actual sobre el impacto de la COVID-19 en la microbiota intestinal humana, así como las asociaciones entre la composición de la microbiota intestinal y la gravedad de la COVID-19.
La COVID-19 es una enfermedad respiratoria causada por un nuevo coronavirus (SARS-CoV-2) que actualmente sigue afectando a decenas de millones de personas en todo el mundo. Aunque la mayoría de los pacientes con COVID-19 presenta síntomas respiratorios, hasta un 20 % muestra síntomas gastrointestinales (GI) como diarrea [1], lo que sugiere que el tubo digestivo es un foco extrapulmonar de la infección por SARS-CoV-2 y de expresión de esta enfermedad. Además, la COVID-19 presenta un amplio abanico de niveles de gravedad, que va desde ser asintomática, leve, grave, hasta crítica con insuficiencia respiratoria e incluso la muerte [2].
El tracto gastrointestinal es el órgano inmunitario más grande en los seres humanos, y desempeña funciones decisivas en la defensa del anfitrión ante infecciones por patógenos. Hay billones de microorganismos que viven y colonizan el intestino humano –bacterias, hongos, virus y otras formas de vida que en conjunto se conocen como microbiota– que regulan la inmunidad del anfitrión. Por tanto, es de vital importancia entender si la microbiota intestinal modula la susceptibilidad del anfitrión a la infección por SARS-CoV-2 y su gravedad, así como el impacto de la infección por SARS CoV-2 en la microbiota intestinal del anfitrión y su efecto posterior a largo plazo en la salud humana.
La microbiota intestinal y la COVID-19
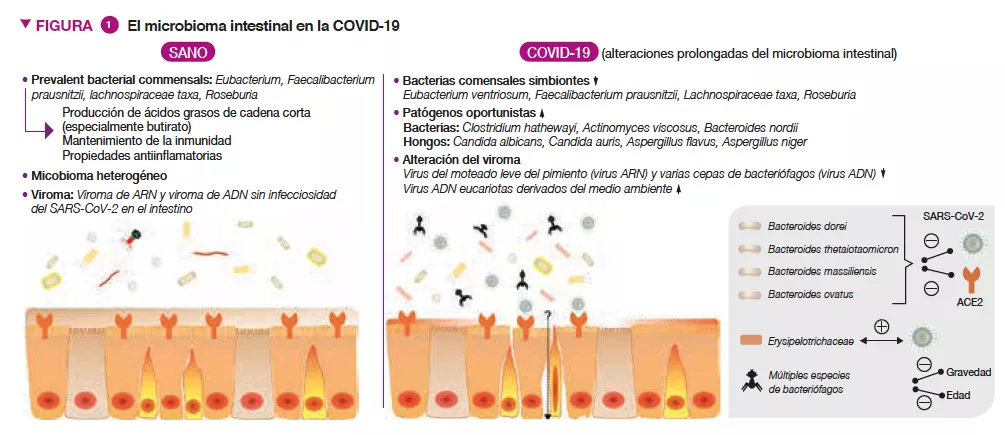
Pacientes con COVID-19 presentaron, en comparación con personas sanas, alteraciones significativas en el microbioma intestinal, caracterizadas por una disminución de bacterias comensales beneficiosas y un aumento de patógenos oportunistas en el intestino (Figura 1) [3]. La disminución de los simbiontes intestinales persistió incluso después de la resolución de la COVID-19. Los valores de referencia (en el momento de la hospitalización) de abundancia para las bacterias Coprobacillus, Clostridium ramosum y C. hathewayi se correlacionaron positivamente con la gravedad de la COVID-19, mientras que había una correlación inversa entre la abundancia de Faecalibacterium prausnitzii (conocida por ser una bacteria antinflamatoria) y la gravedad de la enfermedad. El SARS-CoV-2 utiliza el receptor de la enzima convertidora de angiotensina 2 (ECA2) para entrar en el anfitrión, y este receptor se encuentra altamente expresado tanto en el tracto respiratorio como en el gastrointestinal [4]. La ECA2 es importante para controlar la inflamación intestinal y la ecología microbiana del intestino [5]. Se observó que cuatro especies de Bacteroides, B. dorei, B. thetaiotaomicron, B. massiliensis, y B. ovatus, se asociaban negativamente con la expresión de la ECA2 en el intestino del ratón [6]. Curiosamente, su abundancia en el microbioma fecal también mostró una correlación inversa con la carga vírica fecal de SARS-CoV-2 en pacientes con COVID-19 durante el curso de la enfermedad. Estos resultados sugieren que la COVID-19 perjudica a la MI humana y que es posible que esta module la defensa del anfitrión frente a la infección por SARS-CoV-2.
El microbioma fúngico y la COVID-19
El tracto gastrointestinal también alberga un amplio número de hongos, conocidos de forma colectiva como micobioma (microbioma fúngico), el cual se ha demostrado que está implicado de forma causal en la formación de la MI y en el desarrollo inmunitario [7]. Pacientes con COVID-19 también presentaban micobiomas intestinales alterados, caracterizados por un enriquecimiento de Candida albicans y configuraciones de micobioma muy heterogéneas (Figura 1) [8]. La diversidad del micobioma fecal en los pacientes con COVID-19 en el momento del alta era 2,5 veces superior a la de personas sanas. Había una fuerte presencia de hongos patógenos oportunistas como Candida albicans, C. auris y Aspergillus flavus en las heces de pacientes con COVID-19 durante el curso de la enfermedad. Se detectaron dos hongos patógenos asociados a síntomas respiratorios, A.lavus y A.niger, en muestras fecales de un subconjunto de pacientes con COVID-19, incluso después de la resolución de la enfermedad. En un 30 % de pacientes con COVID-19 persistieron micobiomas intestinales inestables y disbiosis.
El viroma intestinal y la COVID-19
Mediante secuenciación de escopeta de ARN vírico se encontró una firma de infección vírica intestinal activa en el 47 % de los pacientes con COVID-19, incluso en ausencia de síntomas gastrointestinales y después de la eliminación respiratoria del SARS-CoV-2 [9], lo que sugiere una infección «latente» por SARS-CoV-2 en el tracto gastrointestinal y un posible riesgo de transmisión fecal-oral. Los pacientes con esta actividad gastrointestinal del SARSCoV- 2 albergaban composiciones y funciones anómalas de la MI, caracterizadas por una gran abundancia de patógenos oportunistas y una mayor capacidad de biosíntesis de nucleótidos y aminoácidos y del metabolismo de los hidratos de carbono (glucólisis) [9].
El tracto gastrointestinal humano también alberga abundantes elementos víricos / bacteriófagos conocidos de forma colectiva como viroma intestinal. Pacientes con COVID-19 tenían una infrarrepresentación del virus del moteado leve del pimiento (virus ARN) y varias cepas de bacteriófagos (virus ADN) y un aumento de virus de ADN eucariotas derivados del entorno en muestras fecales, en comparación con personas sin COVID-19 (Figura 1) [10]. El viroma fecal en la infección por SARS CoV-2 reveló una mayor capacidad de codificación de genes asociados al estrés, la inflamación y la virulencia. En los valores de referencia del paciente, las abundancias fecales de virus ARN, del virus del mosaico suave del pimiento y de varias especies bacteriófagas se correlacionaban de manera inversa con la gravedad de la COVID-19. Estos virus también estaban asociados negativamente con los niveles en sangre de proteínas proinflamatorias, glóbulos blancos y neutrófilos, lo que indica que es posible que los virus residentes en el intestino modulen la respuesta inmunitaria a la infección por SARS-CoV-2. Entre las especies de virus ADN asociadas a la gravedad de la COVID-19, se observó que el 40 % de las especies tenían una relación inversa con la edad, lo que podría respaldar la observación de que las personas de edad avanzada presentan un mayor riesgo de padecer una COVID-19 más grave.
Conclusión
En resumen, el conjunto de pruebas sugiere que el microbioma intestinal humano (microbiota bacteriana, micobioma y viroma) se altera en caso de COVID-19. Esta alteración persiste incluso después de la resolución de la enfermedad, lo que, a largo plazo, puede suponer una amenaza para la salud del anfitrión. La composición de la microbiota intestinal se asocia con las respuestas inmunitarias del anfitrión y la gravedad de la COVID-19 en la infección por SARS CoV-2. Es necesario investigar más para explorar los efectos a largo plazo de la COVID-19 y para mejorar el microbioma intestinal del anfitrión y su inmunidad ante esta pandemia vírica sin precedentes.






