Un análisis multiómico longitudinal revela mecanismos específicos subyacentes al síndrome del intestino irritable en subgrupos de pacientes
Artículo comentado - Adulto
Por el Prof. Harry Sokol
Gastroenterología y nutrición, Hospital Saint-Antoine, París, Francia
Espacio para el público general
Encuentra aquí tu espacio dedicado
en_sources_title
en_sources_text_start en_sources_text_end
Capítulos
Acerca de este artículo
Autor
Comentario sobre el artículo original de Mars et al. Cell 20201
TEl microbioma intestinal está implicado en gran cantidad de tr astornos gastrointestinales crónicos en humanos. Sin embargo, la falta de correlación entre estudios hechos en animales y en humanos y la ausencia de una perspectiva multiómica integrada de los cambios fisiológicos específicos de l a enfermedad dificultan la determinación de su función. Los autores han integrado datos multiómicos longitudinales del microbioma intestinal, del metaboloma, del epigenoma del hospedador y del transcriptoma, en el contexto de la fisiología de pacientes con síndrome del intestino irritable (SII). Asimismo, han identificado variaciones específicas de subtipos de SII en la composición y l as funciones microbianas, y relacionadas con la sintomatología. Un subconjunto de cambios identificados en metabolitos microbianos corresponde a mecanismos fisiológicos del huésped pertinentes para el SII. Los autores, tras recopilar varios niveles de datos, han identificado el metabolismo de las purinas como una nueva v ía del metabolismo hospedador-microbiota en el SII, con una aplicación terapéutica potencial. Este estudio hace hincapié en el interés que presentan el mues treo longitudinal y la integración de datos multiómicos complementarios para identificar los mecanismos funcionales que pueden ser dianas ter apéuticas en una estrategia de tratamiento global de las enfermedades intestinales crónicas.
¿Qué se sabe ya sobre este tema?
IEl síndrome del intestino irritable (SII) es un trastorno observado en pacientes de todo el mundo que se caracteriza por un dolor o una incomodidad abdominal recurrente. El SII, que se manifiesta principalmente en mujeres, está asociado a cambios en la forma o la frecuencia de las heces; son esas formas las que definen los subtipos del SII: con predominio de estreñimiento (SII-E), con predominio de diarrea (SII-D) o mixto (SII-M).
La patogénesis del SII conlleva modificaciones en la motilidad gastrointestinal, en la secreción intestinal, en la hipersensibilidad visceral y en la permeabilidad intestinal, y todas ellas pueden ser modificadas por el microbioma intestinal [2]. Además, los síntomas del SII se ven afectados por el régimen alimenticio, la genética del huésped y el entorno, factores conocidos por modular el microbioma intestinal humano [2]. Las pruebas experimentales que corroboran la función del microbioma intestinal en el SII provienen de experimentos de trasplantes de pacientes a ratones gnotobióticos, en los que se reproducen ciertos síntomas asociados al SII-E y al SII-D (tiempo de tránsito, sensación de dolor, permeabilidad intestinal...). Sin embargo, a falta de modelos robustos de animales con SII, se necesitan estudios en humanos para determinar las interacciones entre el microbioma intestinal y las vías patológicas específicas del ser humano. Los estudios en humanos sobre el SII suelen verse limitados por un muestreo transversal y una falta de estratificación por subgrupos de pacientes, lo que se traduce en una falta de concordancia entre los resultados obtenidos en una cantidad importante de estudios sobre el microbioma [4].
La influencia bien descrita del tránsito gastrointestinal en el microbioma intestinal aumenta todavía más la variabilidad de los estudios. Por otro lado, el SII, al igual que otros trastornos gastrointestinales crónicos, se caracteriza por periodos de remisión y reaparición de los síntomas, pero las muestras transversales no tienen en cuenta la variabilidad de la enfermedad a lo largo del tiempo. Por último, las diferencias inherentes en la fisiología del hospedador entre estudios en seres humanos y en animales han sido un obstáculo para el avance de nuestra comprensión de las funciones del mecanismo del microbioma intestinal en el SII. Los autores han llevado a cabo un estudio longitudinal en subgrupos de pacientes con SII, en el que han integrado mediciones multiómicas, incluido el metagenoma microbiano, el transcriptoma del huésped y el metiloma, con una evaluación de las funciones del anfitrión. Esto ha permitido identificar mecanismos específicos del subtipo de SII, inducidos por un metabolismo microbiano alterado, que correspondía a cambios simultáneos en la fisiología del huésped.
Puntos Clave
-
Las funciones de la microbiota intestinal están alteradas en caso de SII con diferencias entre el SII-E y el SII-D
-
Puede que el aumento de la producción de triptamina y la disminución de la transformación de los ácidos biliares estén implicadas en el SII-D
-
Es posible que un consumo excesivo de hipoxantina por parte de la microbiota y las células del hospedador influyan en el SII alterando el nivel de energía de las células epiteliales intestinales
¿Cuáles son los principales resultados aportados por este estudio?
En el estudio que nos ocupa, los autores han realizado un estudio prospectivo observacional longitudinal con análisis multiómico del microbioma intestinal y de las células del hospedador. Se compararon personas sanas con pacientes con SII-E y SII-D. En total, 77 pacientes proporcionaron al menos una muestra de heces (se obtuvo un total de 474 muestras de heces), y 42 participantes se sometieron a una sigmoidoscopia para obtener biopsias del colon. Para identificar los factores microbianos que determinan los síntomas específicos de los subtipos de SII, se realizaron una secuenciación metagenómica y un análisis metabolómico de las muestras de heces. El análisis metabolómico y las mediciones de citocinas se realizaron en las muestras de suero. Por último, se realizó una secuenciación del gen 16S y un análisis del metaboloma, del transcriptoma y del metiloma en las biopsias del colon.
Los autores hallaron diferencias en la composición y la diversidad de la microbiota intestinal entre las personas sanas y los pacientes SII-E o SII-D.
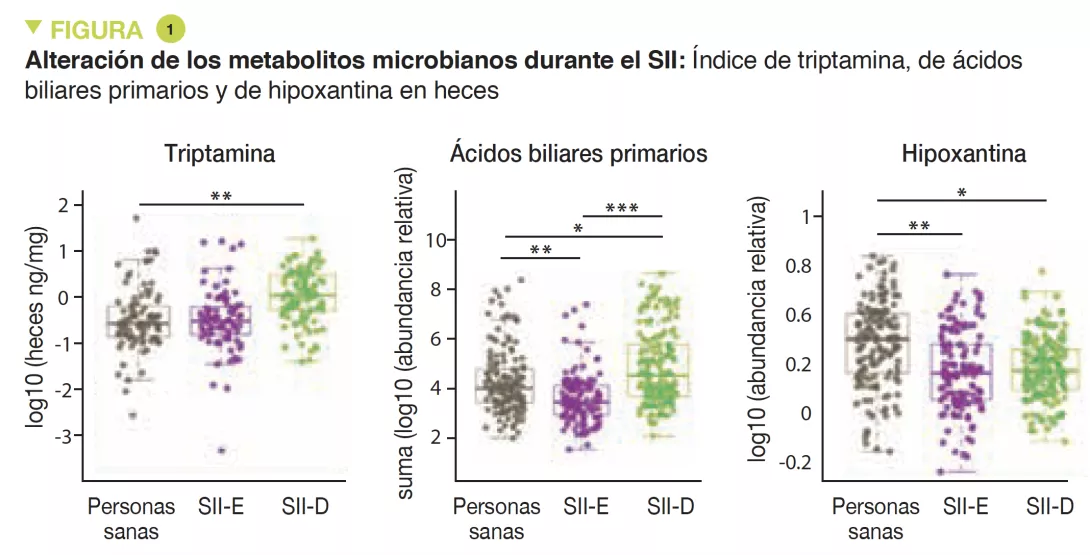
El análisis metabolómico de las heces reveló un aumento de la triptamina, un metabolito del triptófano producido por ciertas bacterias intestinales, en los pacientes con SII-D (Figura 1). Dado que la triptamina produce un efecto de aceleración del tránsito debido a una acción sobre el receptor de la serotonina 5-HT4, es posible que influya en el fenotipo de estos pacientes. De forma similar, la proporción de ácidos biliares primarios era más elevada en pacientes con SII-D, lo que indica una disfunción en su transformación por la microbiota. Los experimentos in vitro sugirieron que los ácidos biliares primarios aumentan la secreción cólica por lo que también es posible que influyan en el fenotipo.
Por último, la integración de los datos multiómicos reveló un posible nuevo mecanismo en el SII. Los resultados sugieren que en los pacientes con SII se produce un mayor deterioro de los nucleótidos de purinas, y en concreto de la hipoxantina, por parte de la microbiota y de las células del hospedador, lo cual provoca estrés en el colon. Es posible que esto cause una respuesta compensatoria con un aumento de la recuperación de purinas. Niveles bajos de nucleótidos de purinas pueden llevar a una disminución del estado de energía epitelial y de la capacidad para reparar la mucosa intestinal, lo que también podría contribuir a la fisiopatología del SII.
¿Cuáles son las consecuencias en la práctica?
Estos datos sugieren que la microbiota intestinal influye en la fisiopatología del SII, con diferencias entre el SII-E y el SII-D. Por otro lado, estos resultados sugieren que también puede afectar una insuficiencia de nucleótidos de purinas, en concreto, a causa de un consumo excesivo de hipoxantina por parte de la microbiota y de las células del huésped. Estos resultados abren el camino a tratamientos que estimulen la producción de hipoxantina microbiana o que inhiban localmente la xantina oxidasa en el intestino.
Conclusión
Este estudio longitudinal multiómico demuestra por qué son interesantes los estudios longitudinales en humanos y pone de relieve las alteraciones funcionales de la microbiota durante el SII que, posiblemente, estén implicadas en su fisiopatología. Puede que estas nuevas pistas identificadas se conviertan a su vez en nuevas dianas terapéuticas.