Analise multiomica longitudinal revela mecanismos especificos do subconjunto subjacentes a sindrome do intestino irritavel
Artigo comentado
Pelo Prof. Harry Sokol
Gastroenterologia e Nutrição, Hospital Saint-Antoine, Paris, França
Área para o público geral
Encontre aqui o seu espaço dedicado
en_sources_title
en_sources_text_start en_sources_text_end
Capítulos
Sobre este artigo
Autor
Commentary on the original article by Mars et al. Cell 2020 [1]
O microbioma intestinal está implicado em inúmeros distúrbios gastrointestinais crónicos nos seres humanos. No entanto, a determinação do seu papel tem sido dificultada devido à falta de correlação entre estudos animais e humanos, bem como de uma visão multiómica integrada das alterações fisiológic as específicas da doença. Os autores integraram dados multiómicos longitudinais do microbioma intestinal, do metaboloma, do epigenoma hospedeiro e do transcriptoma no contexto da fisiologia hospedeira da síndrome do intestino ir ritável (SII). Identificaram variações específicas do subtipo de SII e relaciona das com os sintomas na composição e função microbiana. Um subgrupo de alterações identificadas nos metabolitos microbianos corresponde aos mecanismos fisiológicos do hospedeiro que são relevantes para a SII. Ao compilar múltiplas camadas de dados, os autores identificaram o metabolismo purina como sendo uma nova via metabólica hospedeiro- microbiota na SII com potencial aplicação terapêutica. Este estudo destaca o valor da amostragem longitudinal e a integração de dados multiómicos complementares na identifica ção de mecanismos funcionais que podem ser alvos terapêuticos futuros numa estratégia global de tratamento de doenças intestinais crónicas.
O QUE É QUE JÁ SABEMOS SOBRE ISTO?
A síndrome do intestino irritável (SII) é um distúrbio observado em pacientes em todo o mundo, caracterizada por dor ou desconforto abdominal recorrente. Ocorrendo principalmente nas mulheres, a SII está associada a alterações na forma ou frequência das fezes e é a forma desta última que define os subconjuntos da SII: SII com obstipação (SII-C), SII com diarreia (SII-D) ou SII com hábitos intestinais mistos (SII-M).
A patogénese da SII envolve alterações na motilidade gastrointestinal, secreção intestinal, hipersensibilidade visceral e permeabilidade intestinal, podendo todas elas ser modificadas pelo microbioma intestinal [2]. Além disso, os sintomas da SII são influenciados pela dieta, pela genética do hospedeiro e pelo ambiente, que também são conhecidos por modularem o microbioma intestinal humano [2]. A evidência experimental que apoia o papel do microbioma intestinal na SII baseiase em estudos de transplante em ratinhos, paciente-para-gnotobiótico que reproduziram determinados sintomas associados à SII-C e SII-D (tempo de trânsito, sensação de dor, permeabilidade intestinal...) [3]. No entanto, na ausência de modelos animais robustos para o estudo da SII são necessários, inclusive estudos em seres humanos para determinar as interações entre o microbioma intestinal e as vias patológicas específicas Os estudos da SII em seres humanos são limitados em geral pela utilização de amostragem transversal e pela não estratificação em subconjuntos de pacientes, o que se reflete na falta de concordância nos resultados obtidos no grande número de estudos sobre o microbioma [4].
A influência bem descrita do trânsito gastrointestinal no microbioma intestinal aumenta ainda mais a variabilidade dos estudos. Além disso, a SII, em comum com outras doenças gastrointestinais crónicas, caracteriza-se por períodos de remissão e exacerbação dos sintomas pelo que, por conseguinte, a amostragem transversal não consegue ter em conta as flutuações da doença ao longo do tempo. Por último, as diferenças inerentes à fisiologia do hospedeiro entre seres humanos e animais têm sido um obstáculo ao progresso na nossa compreensão dos papéis mecanicistas do microbioma intestinal na SII. Os autores realizaram um estudo longitudinal em subconjuntos de pacientes com SII, integrando medições multiómicas, incluindo o metagenoma microbiano, o transcriptoma do hospedeiro e o metiloma com avaliação das funções das células hospedeiras. Isto revelou mecanismos específicos do subconjunto da SII induzidos por metabolismo microbiano deficiente, que correspondiam a alterações simultâneas na fisiologia do hospedeiro.
Pontos chave
- As funções da microbiota intestinal são prejudicadas na SII e existem diferenças entre a SII-C e a SII-D
- O aumento da produção de triptamina e a redução da transformação dos ácidos biliares podem estar implicados na SII-D
- O consumo excessivo de hipoxantina pela microbiota e pelas células hospedeiras pode ser implicado na SII alterando o nível de energia das células do epitélio da mucosa intestinal
QUAIS SÃO AS PRINCIPAIS CONCLUSÕES DESTE ESTUDO?
Aqui, os autores realizaram um estudo prospetivo longitudinal observacional com análise multiómica do microbioma intestinal e das células hospedeiras. Os indivíduos saudáveis foram comparados com pacientes com SII-C e SII-D. Numtotal de 77 participantes que forneceu pelo menos uma amostra de fezes (foram obtidas um total de 474 amostras de fezes), 42 dos participantes efetuaram uma sigmoidoscopia para a realização de biopsias do cólon. A fim de identificar os fatores microbianos que causam os sintomas específicos de cada um dos subconjuntos da SII, foi realizada uma sequenciação metagenómica e uma análise metabólica nas amostras de fezes. Realizou-se uma análise metabolómica e ensaios de citocinas em amostras de soro. Por último, realizaram-se 16 sequenciações de S, e análises metabolómicas, transcriptómicas e metilómicas debiopsias do cólon. Os autores identificaram diferenças na composição e diversidade da microbiota intestinal entre indivíduos saudáveis e pacientes com SII-C ou SII-D.
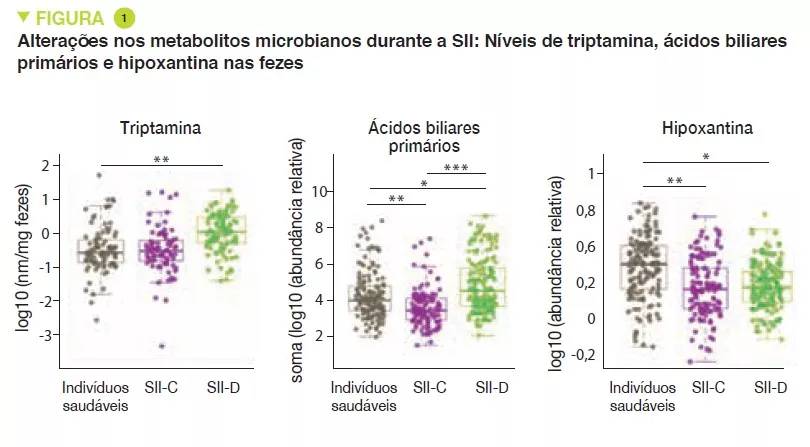
A análise metabolómica das fezes revelou níveis aumentados de triptamina, um metabolito de triptofano produzido por determinadas bactérias intestinais, em pacientes com SII-D (Figura 1). Como a triptamina acelera o trânsito devido a uma ação sobre o recetor de serotonina, 5-HT4, sugere- se que poderia ter um papel no fenótipo destes pacientes. Do mesmo modo, a proporção de ácidos biliares primários foi maior nos pacientes com SII-D, um sinal de transformação deficiente dos ácidos biliares pela microbiota. Experiências in vitro sugerem que os ácidos biliares primários aumentam a secreção no cólon e poderiam também participar no fenótipo.
Por último, a integração de dados multiómicos identificou um novo mecanismo potencial para a SII. Os resultados sugerem que nos pacientes com SII há uma degradação crescente dos nucleótidos purínicos e da hipoxantina em particular, pela microbiota e pelas células hospedeiras, o que induz o stress no cólon. Sugere-se que isto poderia levar a uma resposta compensatória com um aumento na recuperação da purina. Os níveis baixos de nucleótidos purínicos poderiam levar a uma fonte de energia reduzida para o epitélio da mucosa e a uma capacidade reduzida para a reparação da mucosa intestinal, o que poderia contribuir parcialmente para a fisiopatologia da SII.
QUAIS SÃO AS CONSEQUÊNCIAS PRÁTICAS?
Estes dados sugerem um papel da microbiota intestinal na fisiopatologia da SII, com diferenças entre a SII-C e a SII-D. Além disso, estes resultados apontam para o papel potencial de uma deficiência em nucleótidos purínicos, em particular através de um consumo excessivo de hipoxantina pela microbiota e pelas células hospedeiras. Estes resultados apontam o caminho para tratamentos que estimulam a produção de hipoxantina microbiana ou que inibem localmente a xantina oxidase no intestino.
Conclusão
Este estudo longitudinal com multiómica integrada mostra o valor dos estudos longitudinais em seres humanos e destaca alterações funcionais da microbiota na SII que podem estar potencialmente implicadas na fisiopatologia desta doença. As novas pistas que foram identificadas podem ser novos alvos terapêuticos.






