Dialogo entre a microbiota intestinal e as respostas imunitarias do hospedeiro para combater as infeções pela
Síntese
Pelo Dra. Dorota Czerucka
Bióloga médica, Equipa eco sistemas e Imunidade, Centro científico do Mónaco, Mónaco
Área para o público geral
Encontre aqui o seu espaço dedicado
en_sources_title
en_sources_text_start en_sources_text_end
Capítulos
Sobre este artigo
Autor
Os seres vivos evoluíram durante milhões de anos em ambientes complexos ocupados por ecossistemas microbianos, e assim forjaram relações simbióticas reguladas pelo sistema imunitário. As novas técnicas de sequenciação revolucionaram os nossos conhecimentos e permitiram revelar que cada indivíduo abriga uma microbiota única, bem como o seu papel na fisiologia do hospedeiro e em muitas doenças como as infeções. O diálogo entre a microbiota intestinal e o sistema imunitário começa na vida fetal. A organização específica da microbiota – separada do hospedeiro por uma monocamada celular – representa um desafio particular para o sistema imunitário, cujo papel é reconhecer o “não-eu” como um sinal, potencial de infeção, de modo a iniciar as cascatas imunitárias. Por conseguinte, as trocas contínuas com a microbiota têm um impacto considerável no sistema imunitário do hospedeiro. A resposta imunitária, que devem incluir a microbiota, tem também um impacto quer na composição quer na função. Assim, as trocas bidirecionais e constantes entre estas duas entidades modelam tanto a imunidade do hospedeiro como a microbiota intestinal para proteger contra infeções e muitas doenças.
MICROBIOTA INTESTINAL E A BARREIRA INTESTINAL
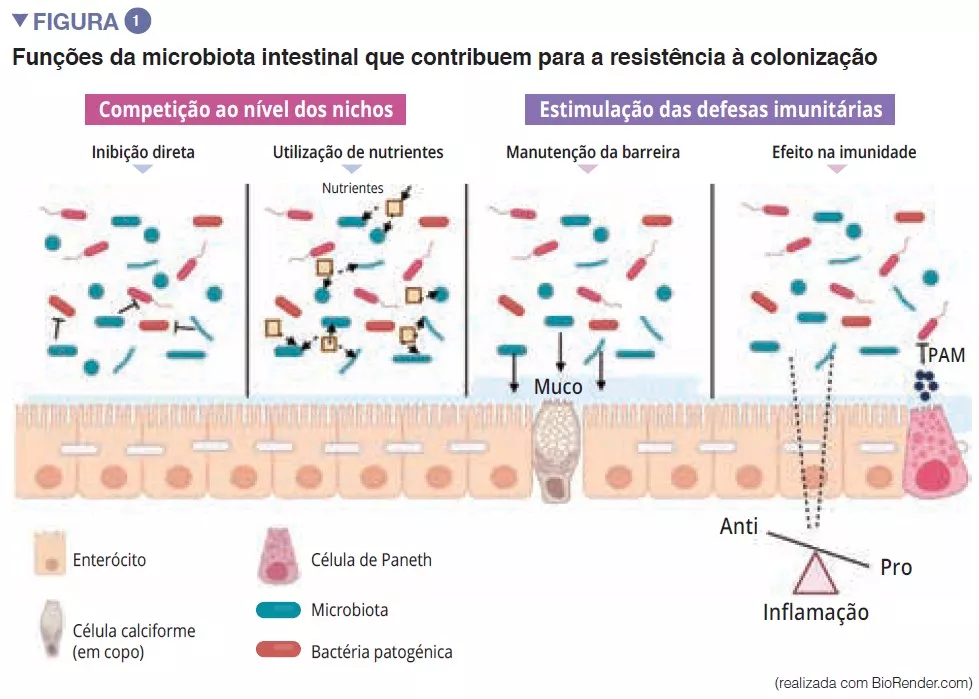
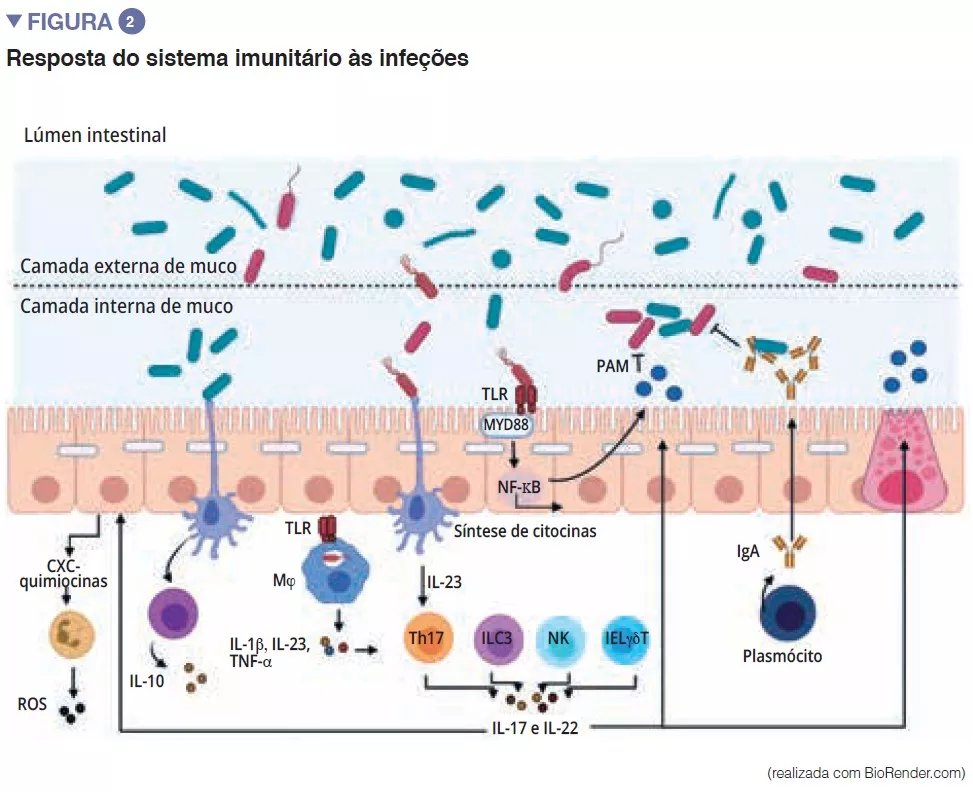
A microbiota intestinal é constituída por uma primeira barreira que protege a mucosa intestinal dos agentes patogénicos. Este complexo ecossistema habita de forma estável no trato gastrointestinal e limita o acesso aos nichos do intestino bem como aos nutrientes necessários para a multiplicação das bactérias exógenas do intestino através do fenómeno de“resistência à colonização” [1] (Figura 1). Os enterócitos, que asseguram uma barreira física entre o lúmen intestinal e o hospedeiro, absorvem a água e os nutrientes, e segregam péptidos antimicrobianos PAM (RegIIIg, b-defensins e cathelicidin) [2]. Graças ao reconhecimento dos padrões moleculares associados aos microrganismos (Microbe-Associated Molecular Patterns, MAMP) por recetores específicos (incluindo os Toll-Like-Receptors, TLR), estas células serão capazes de traduzir o sinal em citocinas e quimiocinas para assinalar uma infeção e recrutar as células imunitárias (Figura 2). As células de Paneth participam na resistência à colonização ao segregarem também PAM (lisozima, a-defensinas, RegIIIg) [2]. As células caliciformes – secretoras de muco – e as células M têm a capacidade de fazer passar antigénios intactos e aleatoriamente capturados no lúmen intestinal a partir das bactérias comensais, dos agentes patogénicos ou dos antigénios alimentares. Estas serão, em seguida, preparados pelas células dendríticas (CD) e apresentados às células da imunidade adaptativa. Esta função é essencial para a tolerância intestinal e a indução das respostas imunitárias da mucosa [2]: um equilíbrio entre respostas pró- e anti-inflamatórias que ocorrem, de forma permanente (Figura 2). Tudo isto foi demonstrado em modelos murinos de colite induzida e em ratos com depleção de recetores TLR: a ausência de microbiota ou de reconhecimento desta reduz a proliferação das células epiteliais intestinais ou a reparação da barreira [2]. Por último, o muco também proporciona proteção através da captura dos PAM que manterão os agentes patogénicos afastados do epitélio. Num modelo de rato deficiente em Muc2 (um gene que codifica uma das proteínas que compõem o muco), observa-se um aumento na translocação de bactérias comensais e estes animais desenvolvem doenças inflamatórias intestinais [3].
DIÁLOGO ENTRE A MICROBIOTA INTESTINAL E O SISTEMA IMUNITÁRIO INATO
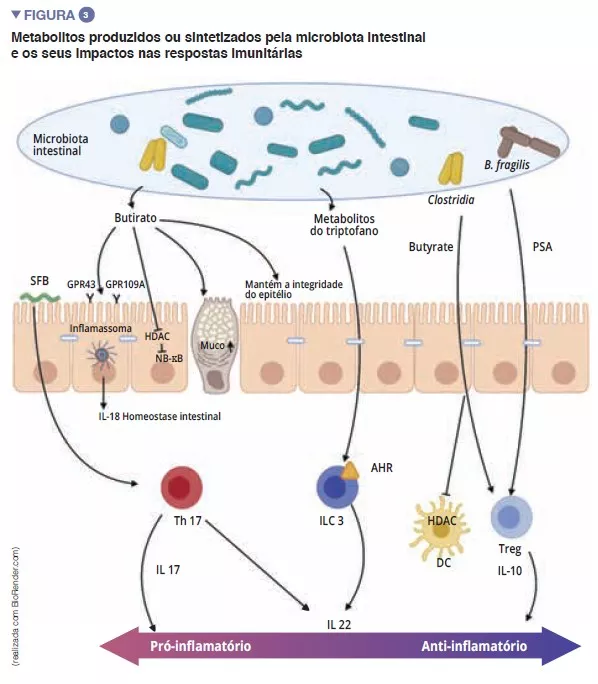
Entre os atores do sistema imunitário inato envolvidos na homeostase intestinal, as células apresentadoras de antigénios (CPA), tais como os macrófagos (Mj) e as CD têm um papel importante. Os Mj e as CD sintetizam a IL-10 e, assim, promovem a diferenciação em Treg [4], bem como a maturação dos linfócitos Th17 através do envolvimento de bactérias comensais: as bactérias segmentadas filamentosas (Segmented Filamentous Bacteria, SFB). Estas bactérias têm a particularidade de aderir às células epiteliais intestinais, levando a uma estimulação ativa do sistema imunitário [5] (Figura 3). Um estudo mostra que a colonização de ratos por estas SFB induz a diferenciação de Th17 e exerce, assim, uma proteção contra o Citrobacter
rodentium (equivalente murino dos EPEC e EHEC). Esta proteção é atribuída à capacidade a maturação dos linfócitos Th17 uma citocina conhecida
por estimular a síntese dos PAM [6]. As CD, por outro lado, são capazes de fagocitar bactérias presentes no lúmen intestinal graças a uma extensão das suas dendrites entre as células epiteliais. Estas bactérias comensais são, em seguida, transportadas até aos gânglios linfáticos mesentéricos para induzir a produção de IgA segregada pelos plasmócitos [1].
As células linfoides inatas (Innate Lymphoid Cells, ILC) também desempenham um papel importante na homeostase intestinal através da sua capacidade de iniciar e orientar as respostas imunitárias intestinais. Em particular, as ILC de tipo 3 (ILC3) têm um lugar especial na interação com a microbiota intestinal. Através da síntese da IL-22, estas células estimulam a produção de muco, de PAM, bem como a secreção de quimiocinas e o recrutamento de células polimorfonucleares (PMN) (Figura 2) [1].
DIÁLOGO ENTRE A MICROBIOTA E O SISTEMA IMUNITÁRIO ADAPTATIVO
A maturação final do sistema imunitário adaptativo é caracterizada pelo povoamento da mucosa intestinal com linfócitos maduros efetores T pró-inflamatórios (Th17), anti-inflamatórios (Treg) e linfócitos B (Figura 2). Para além dos efeitos sobre os macrófagos e a diferenciação dos Th17, as SFB estimulam também o desenvolvimento dos órgãos linfoides e participam na diferenciação dos linfócitos B em plasmócitos produtores de IgA que conterão as bactérias patogénicas no muco [5]. Outras bactérias comensais podem estimular as respostas imunitárias adaptativas: uma mistura de 17 estirpes de Clostridia, isolada de uma amostra fecal humana e introduzida em ratos induz uma resposta anti-inflamatória ao estimular os Treg [7]. Faecalibacterium prausnitzi também foi identificado pela sua ação anti-inflamatória in vitro e in vivo ao atuar sobre o fator NF-kB, as CD e Mj que segrega IL-10 e promove a diferenciação dos Treg à custa dos Th17 [8]. Entre os Bacteroidetes, Bacteroides fragilis e B. thetaiotaomicron foram também descritos como exercendo uma atividade anti-inflamatória. B. fragilis sintetizando um polissacarídeo A (PSA) que suprime a produção pró-inflamatória de IL 17, e estimula a secreção anti-inflamatória de IL-10 (Figura 3). Num modelo específico de colite induzida por Helicobacter hepaticus, o PSA estimula o desenvolvimento dos órgãos linfoides, estimula o linfócito Treg e protege os ratos [9].
METABOLITOS MICROBIANOS: MEDIADORES
IMPORTANTES DO DIÁLOGO ENTRE A MICROBIOTA E A IMUNIDADE ADAPTATIVA
Os ácidos gordos de cadeia curta (AGCC), os metabolitos derivados do triptofano e os sais biliares são os principais metabolitos derivados da microbiota intestinal que exercem um efeito protetor contra as infeções [9, 10]. Sabe-se que o butirato, o propionato e o succinato têm ações na homeostase intestinal, secreção do muco, e também nas diferentes células do sistema imunitário. O butirato exerce, entre outros, efeitos anti-inflamatórios e antimicrobianos. Esta ação é mediada pelos recetores acoplados às proteínas G (GPR) encontrados em células epiteliais e macrófagos [9]. F. prausnitzi é um grande produtor de butirato, o que pode explicar em parte o seu efeito anti-inflamatório. De facto, inibe a ativação de NFkB e, assim, inibe a síntese de citocinas pró-inflamatórias IFN-g, TNF-a, IL-1b, IL-8 pelos enterócitos (Figura 3). Também induz modificações metabólicas e epigenéticas (através das histonas desacetilases HDAC) dos macrófagos em ratos, amplificando assim as suas atividades antimicrobianas in vitro e in vivo [11]. As bactérias comensais também podem metabolizar o triptofano e produzir substâncias antimicrobianas. Assim, os Lactobacilos utilizam-no como fonte de energia para sintetizar um indol que se liga aos recetores de hidratos de carbono arílicos (AhR) presentes nas ILC3. AhR induzirá a secreção de IL-22 pelas ILC e, subsequentemente, a secreção de AMP e induzirá a proteção contra infeções [9].
DIÁLOGO MICROBIOTASISTEMA IMUNITÁRIO INTESTINAL PARA SE PROTEGER CONTRA INFEÇÕES VIRAIS
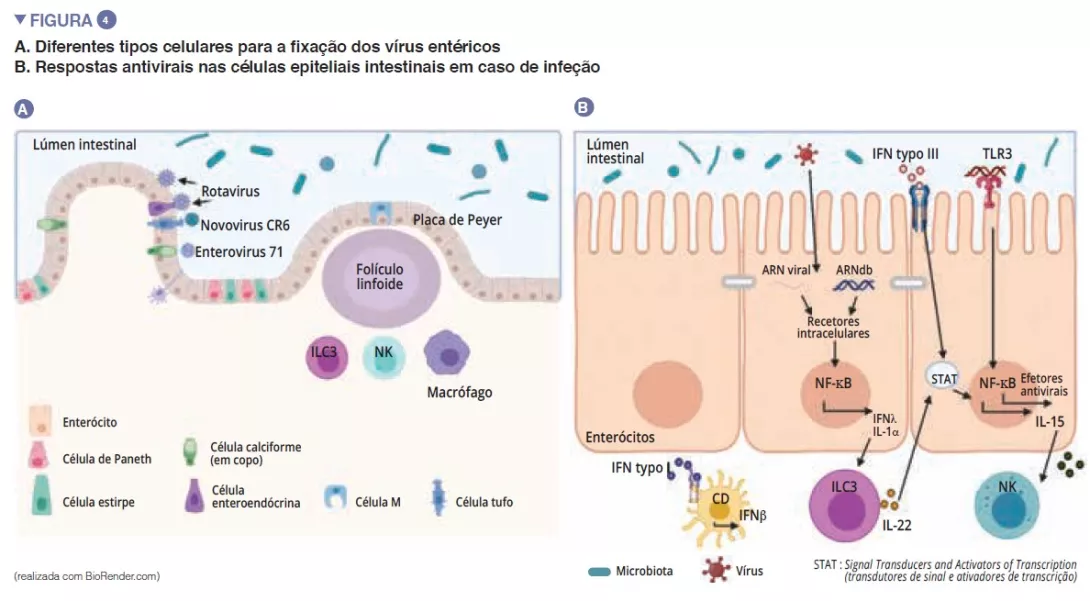
Entre os vírus entéricos, o norovírus e o rotavírus estão as principais causas de gastroenterites [12]. Os vírus entéricos infetam diferentes tipos celulares: os enterovírus 71 infetam especificamente as células caliciformes, enquanto o tropismo dos rotavírus é dirigido principalmente para os enterócitos [13] (Figura 4A). A microbiota intestinal atua como uma barreira contra as infeções virais entéricas. Os vírus evoluíram e adaptaram-se ao seu hospedeiro para desenvolver mecanismos que lhes permitem passar a barreira intestinal e escapar à imunidade de barreira: de facto, é difícil infetar efetivamente, por via oral, os ratos com vírus entéricos humanos [13]. A penetração do vírus no enterócito resulta na secreção do interferão (IFN) de tipo III. A deteção viral pode induzir a IL-la que ativa as ILC3 para produzir IL-22. Esta IL protege contra infeções virais entéricas e atua sinergicamente com os IFN de tipo III para induzir a expressão de efetores antivirais e de IL-15. O reconhecimento viral pelos TLR-3 leva à ativação da via NF-kB e também à produção de IL-15. A IL-15 ativa os linfócitos citotóxicos (células NK). Os vírus que atravessaram a barreira intestinal induzem a produção de IFN tipo I pelos macrófagos na lamina propria (Figura 4B). Alguns vírus entéricos (rotavírus, reovírus enterovírus) são capazes de se ligar às bactérias intestinais, promovendo a penetração nas células epiteliais intestinais [13]. As SFB, que permitem uma renovação epitelial, resultam na proteção contra a infeção pelo rotavírus em ratos ao expulsarem as células infetadas [14]. Os ácidos biliares metabolizados pela microbiota intestinal também desempenham um papel ao protegerem o intestino delgado (mas não o cólon) contra a infeção aguda pelo norovírus em ratos, promovendo a produção de IFN de tipo III a nível do intestino delgado [15].
Conclusão
O estudo das relações entre a microbiota intestinal e a imunidade intestinal é um grande avanço na investigação em gastroenterologia. A homeostase intestinal é mantida graças ao reconhecimento de bactérias comensais pelas células do sistema inato e pelas células do epitélio intestinal, quer por contacto direto (caso das SFB), quer através da síntese de metabolitos saídos da microbiota. A perturbação da homeostase (disbiose intestinal, infeções, etc.) leva a uma estimulação das respostas inatas e a uma ativação do sistema adaptativo. Uma má “gestão” da inflamação poderia levar ao surgimento de doenças como a síndrome do cólon irritável pós-infecioso.
1 Perez-Lopez A, Behnsen J, Nuccio SP, Raffatellu M. Mucosal immunity to pathogenic intestinal bacteria. Nat Rev Immunol 2016 ; 16 : 135-48.
2 Allaire JM, Crowley SM, Law HT, et al. The intestinal epithelium: central coordinator of mucosal immunity. Trends Immunol 2018 ; 39 : 677-96.
3 Van der Sluis M, De Koning BA, De Bruijn AC, et al. Muc2-deficient mice spontaneously develop colitis, indicating that MUC2 is critical for colonic protection. Gastroenterology 2006 ; 131 : 117-29.
4 Kim M, Hill A A, Wu WJ, et al. Intestinal microbes direct CX3CR1+ cells to balance intestinal immunity. Gut Microbes 2018 ; 17 : 151-63.
5 Flanningan KL, Denning TL. Segmented filamentous bacteria-induced immune responses: a balancing act between host protection and autoimmunity. Immunology 2018 ; 154 : 537-46.
6 Ivanov I I, Atarashi K, Manel N, et al. Induction of intestinal Th17 cells by segmented filamentous bacteria. Cell 2009 ; 139 : 485-98.
7 Atarashi K, Tanoue T, Oshima K, et al. Treg induction by rationally selected mixture of Clostridia strains from the human microbiota. Nature 2013 ; 500 : 232-6.
8 Miquel S, Martin R, Rossi O, et al. Faecalibacterium prausnitzi and human intestinal health. Curr Opin Microbiol 2013 ; 16 : 255- 61.
9 Levy M, Blacher E, Elinav E. Microbiome, metabolites and host immunity. Curr Opin Microbiol 2017 ; 35 : 8-15.
10 Michaudel C, Sokol H. The gut microbiota at the service of immunometabolism. Cell Metabolism 2020 ; 32 : 514-23.
11 Schulthess J, Pandey S, Capitani S, et al. The short Chain Fatty Acid Butyrate imprints an antimicrobial program in macrophages. Immunity 2019 ; 50 : 432-45.
12 Bányai K, Estes MK, Martella V, et al. Viral gastroenteritis. Lancet 2018 ; 392 : 175-86.
13 Segrist E, Cherry S. Using diverse model systems to define intestinal epithelial defenses to enteric viral infections. Cell Host Microbe 2020 ; 27 : 329-44.
14 Shi Z, Zou J, Zhang Z, et al. Segmented filamentous bacteria prevent and cure rotavirus infection. Cell 2019 ; 179 : 644-658.e13.
15 Grau KR, Zhu S, Peterson ST, et al. The intestinal regionalization of acute norovirus infection is regulated by the microbiota via bile acid-mediated priming of type III interferon. Nat Microbiol 2020 ; 5 : 84-92.






