Dialogue entre le microbiote intestinal et les réponses immunitaires de l'hôte pour lutter contre les infections
Synthèse
Par le Dr. Dorota Czerucka
Biologie médicale, Équipe écosystèmes et immunité, Centre scientifique de Monaco, Monaco
Section grand public
Retrouvez ici votre espace dédié
en_sources_title
en_sources_text_start en_sources_text_end
Chapitres
A propos de cet article
Auteur
Les êtres vivants ont évolué depuis des millions d’années dans des environnements complexes occupés par des écosystèmes microbiens, et ont ainsi forgé des relations symbiotiques régulées par le système immunitaire. Les nouvelles techniques de séquençage ont révolutionné nos connaissances et ont permis de mettre en évidence que chaque individu héberge un microbiote qui lui est propre, ainsi que son rôle dans la physiologie de l’hôte et de nombreuses maladies telles que les infections. Le dialogue entre le microbiote intestinal et le système immunitaire débute dès la vie foetale. L’organisation spécifique du microbiote – séparé de l’hôte par une monocouche cellulaire – pose un défi particulier pour le système immunitaire, dont le rôle est de reconnaître le « non-soi » comme un potentiel signe d’infection pour initier les cascades immunitaires. Par conséquent, les échanges continuels avec le microbiote ont un impact considérable sur le système immunitaire de l’hôte. La réponse immunitaire, qui doit tolérer le microbiote, a également un impact sur la composition et la fonction du microbiote. Ainsi, les échanges bidirectionnels et constants entre ces deux entités façonnent à la fois l’immunité de l’hôte et le microbiote intestinal pour protéger des infections et de nombreuses pathologies.
Microbiote intestinal et barrière intestinale
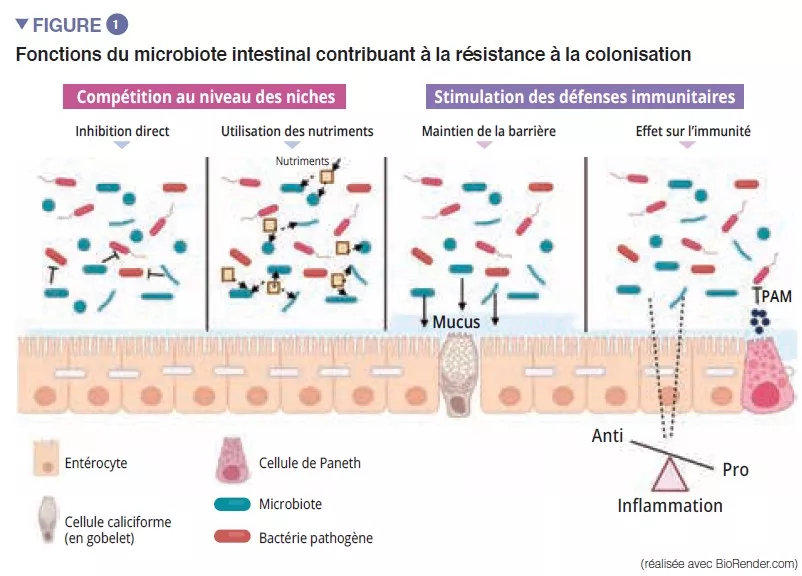
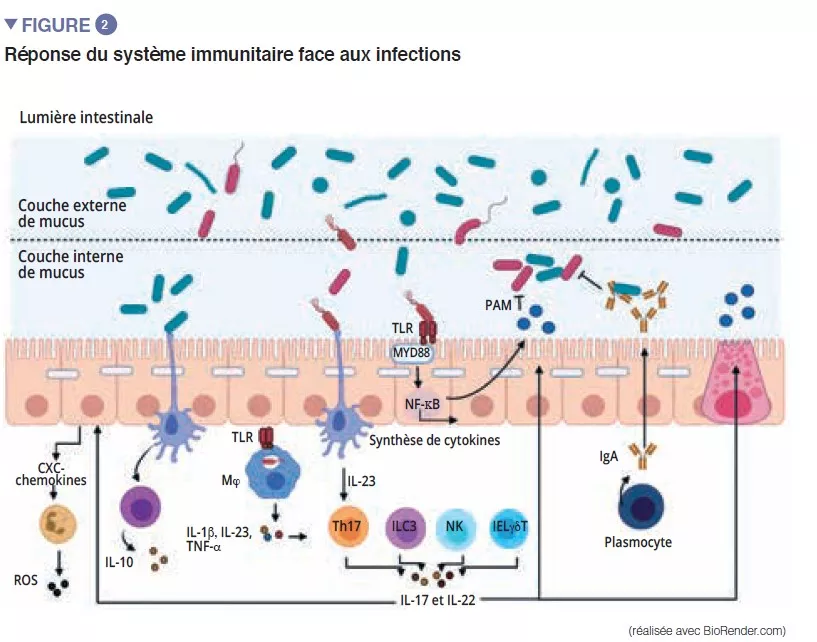
Le microbiote intestinal constitue une première barrière pour protéger la muqueuse intestinale des pathogènes. Cet écosystème complexe habite de manière stable le tractus gastro-intestinal et limite l’accès aux niches de l’intestin ainsi qu’aux nutriments nécessaires à la multiplication des bactéries exogènes à celui-ci par le phénomène de « résistance à la colonisation » [1] (Figure 1). Les entérocytes, qui assurent une barrière physique entre la lumière intestinale et l’hôte, absorbent l’eau et les nutriments, et sécrètent des peptides antimicrobiens PAMs (RegIIIg, b-defensins et cathelicidin) [2]. Grâce à la reconnaissance des motifs moléculaires associés aux micro-organismes (Microbe-Associated Molecular Patterns, MAMPs) par des récepteurs spécifiques (dont les Toll-Like-Receptors, TLR), ces cellules seront capables de transduire le signal en cytokines et chemokines pour signaler une infection et recruter les cellules immunitaires (Figure 2). Les cellules de Paneth participent à la résistance à la colonisation en sécrétant également des PAMs (lysosyme, a-defensins, RegIIIg) [2]. Les cellules caliciformes – sécrétrices de mucus – et les cellules M ont la capacité de faire passer des antigènes intacts et captés au hasard dans la lumière intestinale provenant des bactéries commensales ou des pathogènes ou des antigènes alimentaires. Ceux-ci seront ensuite apprêtés par les cellules dendritiques (CD) et présentés aux cellules de l’immunité adaptative. Cette fonction est primordiale pour la tolérance intestinale et l’induction des réponses immunitaires mucosales [2] : une balance entre des réponses pro- et anti-inflammatoires s’opère donc en permanence (Figure 2). Cela a été notamment démontré dans des modèles murins de colite induite et chez des souris déplétées en récepteurs TLR : l’absence de microbiote ou de reconnaissance de celui-ci réduit la prolifération des cellules épithéliales intestinales ou la réparation de la barrière [2]. Enfin, le mucus assure aussi une protection en capturant les PAM qui vont maintenir les pathogènes éloignées de l’épithélium. Dans un modèle de souris déficiente en Muc2 (gène codant pour une des protéines composant le mucus), on observe une augmentation de la translocation de bactéries commensales et ces animaux développent des maladies inflammatoires intestinales [3].
Dialogue entre le microbiote intestinal et le système immunitaire inné
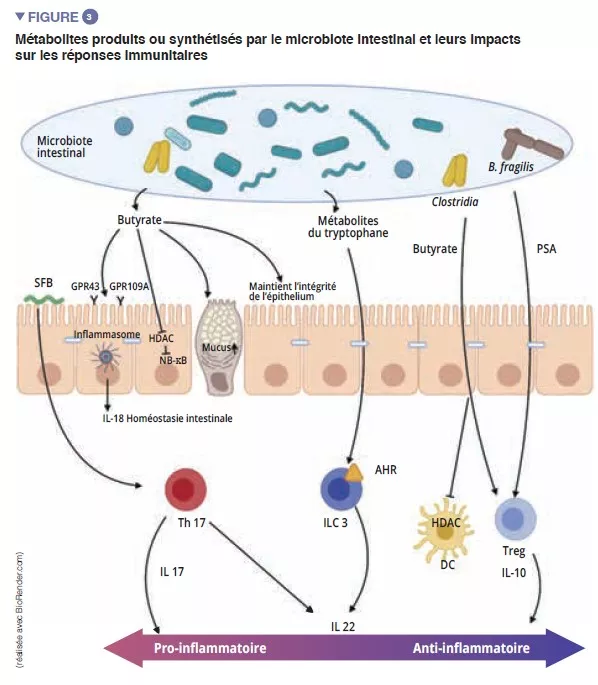
Parmi les acteurs du système immunitaire inné qui participent à l’homéostasie intestinale, les cellules présentatrices d’antigènes (CPA), tels que les macrophages (Mj) et les CD ont un rôle majeur. Les Mj et les CD synthétisent l’IL-10 et favorisent ainsi la différenciation en Treg [4] ainsi que la maturation des lymphocytes Th17 via l’implication de bactéries commensales : les bactéries segmentées filamenteuses (Segmented Filamentous Bacteria, SFB). Celles-ci ont la particularité d’adhérer aux cellules épithéliales intestinales entrainant une active stimulation du système immunitaire [5] (Figure 3). Une étude montre que la colonisation de souris par ces SFB induit la différenciation de Th17 et exerce ainsi une protection vis-à-vis de Citrobacter rodentium (équivalent murin des EPEC et EHEC). Cette protection serait attribuée à la capacité des SFB à stimuler la synthèse d’IL-22 par Th17, cytokine connue pour stimuler la synthèse des PAM [6]. Les CD, quant à elles, sont capables, grâce à une extension de leurs dendrites entre les cellules épithéliales, de phagocyter des bactéries présentes dans la lumière intestinale. Ces bactéries commensales sont ensuite transportées jusqu’aux ganglions lymphatiques mésentériques pour induire la production d’IgA sécrétées par les plasmocytes [1]). Les cellules lymphoïdes innées (Innate Lymphoid Cells, ILC) jouent également un rôle important dans l’homéostasie intestinale, lié à leur capacité à initier et orienter les réponses immunes intestinales. Plus particulièrement, les ILC de type 3 (ILC3) ont une place à part dans l’interaction avec le microbiote intestinal. Au travers de synthèse d’IL-22, ces cellules stimulent la production de mucus, de PAM ainsi que la sécrétion de chemokines et le recrutement de cellules polymorphonucléaires (PMN) (Figure 2) [1].
Dialogue entre le microbiote et le système immunitaire adaptatif
La maturation finale du système immunitaire adaptatif se caractérise par le peuplement de la muqueuse intestinale par des
lymphocytes matures effecteurs T pro-inflammatoires (Th17), anti-inflammatoires (Treg) et des lymphocytes B (Figure 2). En dehors des effets sur les macrophages et la différenciation des Th17, les SFB stimulent également le développement des organes lymphoïdes et participent à la différenciation des lymphocytes B en plasmocytes producteurs d’IgA qui vont contenir les bactéries pathogènes dans le mucus [5]. D’autres bactéries commensales peuvent stimuler les réponses immunitaires adaptatives : un mélange de 17 souches de Clostridia, isolée d’un échantillon fécal humain et introduit chez la souris induit une réponse anti-inflammatoire en stimulant les Treg [7]. Faecalibacterium prausnitzii a aussi été identifié pour son action anti-inflammatoire in vitro et in vivo en agissant sur le facteur NF-kB, les CD et Mj qui sécrète de l’IL-10 et favorise la différenciation des Treg au détriment des Th17 [8]. Parmi les Bacteroidetes, Bacteroides fragilis et B. thetaiotaomicron ont aussi été décrits comme exerçant une activité anti-inflammatoire. B. fragilis synthétise un polysaccharide A (PSA) qui supprime la production pro-inflammatoire d’IL-17, et stimule la sécrétion anti-inflammatoire d’IL- 10 (Figure 3). Dans un modèle spécifique de colite induite par Helicobacter hepaticus, PSA stimule le développement des organes lymphoïdes, stimule le lymphocyte Treg et protège les souris [9].
Les métabolites microbiens : d'importants médiateurs du dialogue entre le microbiote et l'immunité adaptative
Les acides gras à chaîne courte (AGCC), les métabolites dérivés du tryptophane et les sels biliaires sont les principaux métabolites issus du microbiote intestinal exerçant un effet protecteur contre les infections [9, 10]. Le butyrate, propionate, et succinate sont connus pour leurs actions sur l’homéostasie intestinale, sur la sécrétion du mucus, mais également sur les différentes cellules du système immunitaire. Le butyrate exerce entre autres des effets anti-inflammatoires et anti-microbiens. Cette action passe par les récepteurs couplés aux protéines G (GPR) retrouvés sur les cellules épithéliales et les macrophages [9]. F. prausnitzii est un grand producteur de butyrate ce qui peut en partie expliquer son effet anti-inflammatoire. En effet, il inhibe l’activation de NF-kB et inhibe ainsi la synthèse de cytokines pro-inflammatoires IFN-g, TNF-a, IL-1b, IL-8 par les entérocytes [8] (Figure 3). Il induit également des modifications métaboliques et épigénétiques (via les histones deacétylases HDAC) des macrophages chez la souris, amplifiant ainsi leurs activités anti-microbiennes in vitro et in vivo [11]. Les bactéries commensales peuvent aussi métaboliser le tryptophane et produire des substances antimicrobiennes. Ainsi, les Lactobacilli l’utilisent comme source d’énergie pour synthétiser un indole qui se lie aux récepteurs aryl hydrates de carbone (AhR) présents sur les ILC3. AhR va induire la sécrétion d’IL-22 par les ILCs et par la suite la sécrétion d’AMP et induire une protection vis-à-vis des infections [9].
Dialogue microbiote-système immunitaire intestinal pour se protéger des infections virales
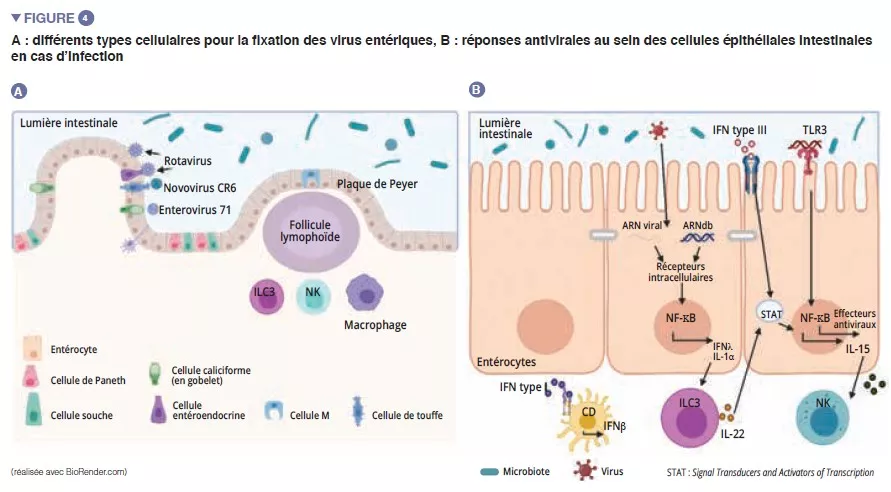
Parmi les virus entériques, le norovirus et le rotavirus sont les principales causes de gastro-entérites [12]. Les virus entériques infectent différents types cellulaires : les entérovirus 71 infectent spécifiquement les cellules caliciformes, tandis que le tropisme des rotavirus est dirigé vers les entérocytes principalement [13] (Figure 4A). Le microbiote intestinal agit comme une barrière contre les infections virales entériques. Les virus ont évolué et se sont adaptés à leur hôte pour mettre en place des mécanismes qui leur permettent de passer la barrière intestinale et d’échapper à l’immunité de barrière : en effet, il est difficile d’infecter efficacement, par voie orale, les souris par des virus entériques humains [13]. La pénétration du virus dans l’entérocyte entraîne la sécrétion d’interféron (IFN) de type III. La détection virale peut induire IL-la qui active les ILC3 pour produire l’IL-22. Cette IL protège des infections virales entériques et agit en synergie avec les IFN de type III pour induire l’expression d’effecteurs antiviraux et d’IL-15. La reconnaissance virale par les TLR-3 conduit à l’activation de la voie NF-kB et également à la production d’IL-15. L’IL-15 active les lymphocytes cytotoxiques (cellules NK). Les virus ayant traversé la barrière intestinale induisent la production d’IFN de type I par les macrophages de la lamina propria (Figure 4B). Certains virus entériques (rotavirus, réovirus, entérovirus) sont capables de se lier aux bactéries intestinales, favorisant la pénétration dans les cellules épithéliales intestinales [13]. Les SFB, qui permettent un renouvellement épithélial, entraînent une protection à l’infection par le rotavirus chez la souris en expulsant les cellules infectées [14]. Les acides biliaires métabolisés par le microbiote intestinal jouent également un rôle en protégeant l’intestin grêle (mais pas le côlon) de l’infection aiguë par le norovirus chez la souris en favorisant la production d’IFN de type III au niveau du grêle [15].
Conclusion
L’étude des relations entre le microbiote intestinal et l’immunité intestinale constitue une grande avancée dans la recherche en gastroentérologie. L’homéostasie intestinale est maintenue grâce à la reconnaissance de bactéries commensales par les cellules du système inné et les cellules de l’épithélium intestinal, soit par un contact direct (cas de SFB), soit via la synthèse de métabolites issus du microbiote. La rupture de l’homéostasie (dysbiose intestinale, infections etc..) entraine une stimulation des réponses innées et une activation du système adaptatif. Une mauvaise « gestion » de l’inflammation pourrait entrainer l’apparition de maladies, telle que le syndrome de l’intestin irritable post-infectieux.
1 Perez-Lopez A, Behnsen J, Nuccio SP, Raffatellu M. Mucosal immunity to pathogenic intestinal bacteria. Nat Rev Immunol 2016 ; 16 : 135-48.
2 Allaire JM, Crowley SM, Law HT, et al. The intestinal epithelium: central coordinator of mucosal immunity. Trends Immunol 2018 ; 39 : 677-96.
3 Van der Sluis M, De Koning BA, De Bruijn AC, et al. Muc2-deficient mice spontaneously develop colitis, indicating that MUC2 is critical for colonic protection. Gastroenterology 2006 ; 131 : 117-29.
4 Kim M, Hill A A, Wu WJ, et al. Intestinal microbes direct CX3CR1+ cells to balance intestinal immunity. Gut Microbes 2018 ; 17 : 151-63.
5 Flanningan KL, Denning TL. Segmented filamentous bacteria-induced immune responses: a balancing act between host protection and autoimmunity. Immunology 2018 ; 154 : 537-46.
6 Ivanov I I, Atarashi K, Manel N, et al. Induction of intestinal Th17 cells by segmented filamentous bacteria. Cell 2009 ; 139 : 485-98.
7 Atarashi K, Tanoue T, Oshima K, et al. Treg induction by rationally selected mixture of Clostridia strains from the human microbiota. Nature 2013 ; 500 : 232-6.
8 Miquel S, Martin R, Rossi O, et al. Faecalibacterium prausnitzi and human intestinal health. Curr Opin Microbiol 2013 ; 16 : 255- 61.
9 Levy M, Blacher E, Elinav E. Microbiome, metabolites and host immunity. Curr Opin Microbiol 2017 ; 35 : 8-15.
10 Michaudel C, Sokol H. The gut microbiota at the service of immunometabolism. Cell Metabolism 2020 ; 32 : 514-23.
11 Schulthess J, Pandey S, Capitani S, et al. The short Chain Fatty Acid Butyrate imprints an antimicrobial program in macrophages. Immunity 2019 ; 50 : 432-45.
12 Bányai K, Estes MK, Martella V, et al. Viral gastroenteritis. Lancet 2018 ; 392 : 175-86.
13 Segrist E, Cherry S. Using diverse model systems to define intestinal epithelial defenses to enteric viral infections. Cell Host Microbe 2020 ; 27 : 329-44.
14 Shi Z, Zou J, Zhang Z, et al. Segmented filamentous bacteria prevent and cure rotavirus infection. Cell 2019 ; 179 : 644-658.e13.
15 Grau KR, Zhu S, Peterson ST, et al. The intestinal regionalization of acute norovirus infection is regulated by the microbiota via bile acid-mediated priming of type III interferon. Nat Microbiol 2020 ; 5 : 84-92.






