Covid-19 & Microbiote Intestinal
Synthèse
Par le Pr. Tao Zuo
Institut de recherche en gastroentérologie de SYSU, Institut de gastroentérologie du Guangdong, sixième hôpital affilié de l’Université Sun Yat-Sen, Guangzhou, Chine
Section grand public
Retrouvez ici votre espace dédié
en_sources_title
en_sources_text_start en_sources_text_end
Chapitres
A propos de cet article
Auteur
Le microbiote intestinal, avec ses fractions bactériennes, fongiques et virales, colonise les intestins humains et régule l’immunité de l’hôte contre l’invasion d’agents pathogènes. La composition largement hétérogène du microbiote intestinal (MI) entre les personnes pourrait influencer les réponses immunitaires de l’hôte à l’infection au SARS-CoV-2, conduisant à des symptômes et des issues différents de la Covid-19. Par ailleurs, même si l’infection au SARS-CoV-2 provoque principalement des symptômes respiratoires, elle dérègle profondément l’immunité systémique de l’hôte et affecte le système gastro-intestinal avec des conséquences à court comme à long terme sur le microbiote intestinal. Nous passons ici en revue les preuves actuelles sur l’impact de la Covid-19 sur le MI humain ainsi que les associations entre la composition du GM et la sévérité de la Covid-19.
La Covid-19 est une maladie respiratoire provoquée par un nouveau coronavirus (SARS-CoV-2) qui touche encore des dizaines de millions de personnes aujourd’hui dans le monde. Même si la majorité des patients Covid-19 présentent des symptômes respiratoires, près de 20 % d’entre eux ont des symptômes gastro-intestinaux, notamment des diarrhées [1], suggérant que le tube digestif est un site extrapulmonaire d’expression de la maladie et d’infection au SARS-CoV-2. De plus, la Covid- 19 présente un large éventail de sévérité de la maladie, allant de formes asymptomatiques à des formes légères, des formes sévères et jusqu’à des formes critiques associées à une insuffisance respiratoire voire au décès [2].
Le tractus gastrointestinal est le plus vaste organe immunitaire chez l’être humain, jouant un rôle essentiel dans la défense de l’hôte contre les infections pathogènes. Des milliers de milliards de micro-organismes vivent dans l’intestin humain et le colonisent – des bactéries, des champignons, des virus et d’autres formes de vie, collectivement appelés microbiote – régulant l’immunité de l’hôte. Il est donc de la plus haute importance de comprendre si le microbiote intestinal module la sensibilité de l’hôte à l’infection au SARS-CoV-2 et la sévérité de celle-ci ainsi que l’impact de l’infection au SARS-CoV-2 sur le GM de l’hôte et ses effets en aval à long terme sur la santé humaine.
Microbiote bactérien intestinal et COVID-19
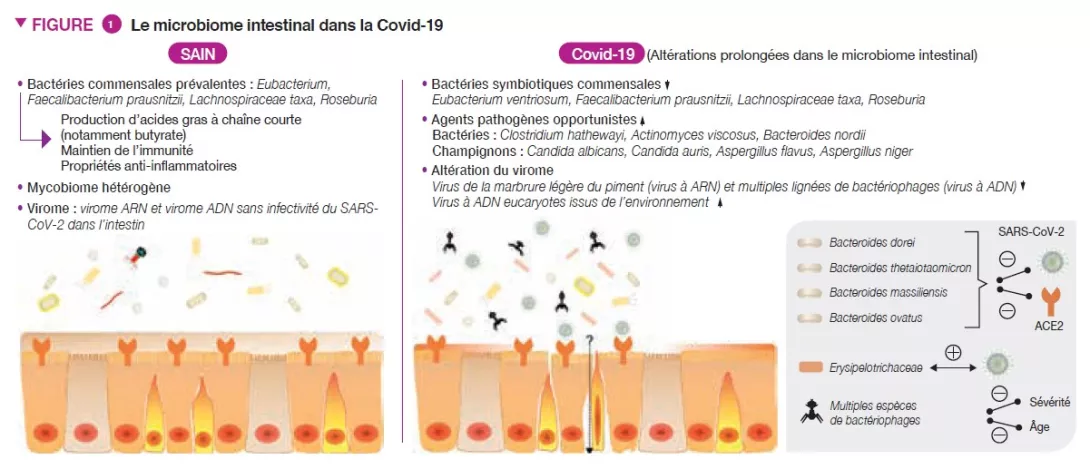
Les patients Covid-19 présentent des altérations importantes du microbiote bactérien intestinal comparativement aux personnes en bonne santé, caractérisées par une déplétion des commensaux bénéfiques et un enrichissement en agents pathogènes opportunistes dans l’intestin (Figure 1) [3]. La déplétion des symbiotes intestinaux a persisté y compris après la résolution de la Covid-19. L’abondance initiale (lors de l’hospitalisation du patient) des bactéries Coprobacillus, Clostridium ramosum et Clostridium hathewayi a montré une corrélation positive avec la sévérité de la Covid 19, tandis qu’une corrélation inverse entre l’abondance de Faecalibacterium prausnitzii (connue pour être une bactérie anti-inflammatoire) et la sévérité de la maladie a été observée. Le SARS-CoV-2 utilise le récepteur de l’enzyme 2 de conversion de l’angiotensine (ACE2) pour pénétrer chez l’hôte et ce récepteur est fortement exprimé à la fois dans les voies respiratoires et dans les voies digestives [4]. L’ACE2 joue un rôle important pour contrôler l’inflammation intestinale et l’écologie microbienne intestinale [5]. Quatre espèces Bacteroides, B. dorei, B. thetaiotaomicron, B. massiliensis et B. ovatus, ont été rapportées comme étant inversement associées à l’expression de l’ACE2 dans l’intestin murin [6]. Il est intéressant de noter que leur abondance respective dans le microbiome fécal a également montré une corrélation inverse avec la charge virale du SARS-CoV-2 dans les matières fécales chez les patients Covid- 19 au cours de l’évolution de la maladie. Ces observations suggèrent que le MI bactérien humain est affecté par la Covid-19 et pourrait calibrer les défenses de l’hôte contre l’infection au SARS-CoV-2.
Microbiome fongique et COVID-19
Le tractus gastro-intestinal abrite également un grand nombre de champignons, collectivement connus sous le nom de mycobiome (microbiome fongique), qui ont été impliqués dans l’assemblage du MI et le développement immunitaire [7]. Les patients atteints de la Covid-19 présentaient également une altération du mycobiome intestinal, caractérisée par un enrichissement en Candida albicans et des configurations du mycobiome hautement hétérogènes (Figure 1) [8]. La diversité du mycobiome fécal chez les patients atteints de la Covid-19 lors de leur sortie de l’hôpital était 2,5 fois plus élevée que chez les personnes en bonne santé. Les agents pathogènes fongiques opportunistes, Candida albicans, C. auris et Aspergillus flavus, étaient fortement présents dans les fèces des patients Covid-19 au cours de l’évolution de la maladie. Deux agents pathogènes fongiques associés à des symptômes respiratoires, A. flavus et A. niger, ont été détectés dans les échantillons fécaux d’un sous-ensemble de patients atteints de la Covid-19, y compris après la résolution de la maladie. Un mycobiome intestinal instable et une dysbiose prolongée ont persisté chez environ 30 % des patients atteints de la Covid-19.
Virome intestinal et COVID-19
Grâce au séquençage aléatoire de l’ARN viral, une signature d’infection virale intestinale active a été retrouvée chez 47 % des patients atteints de la Covid-19, y compris en l’absence de symptômes gastro-intestinaux et après élimination respiratoire du SARS-CoV-2 [9], suggérant une infection « quiescente » au SARS-CoV-2 dans le tractus gastro-intestinal et un risque potentiel de transmission féco-orale. Les patients avec une telle activité gastro-intestinale du SARS-CoV-2 avaient un MI ayant une composition et des fonctions anormales, avec notamment une abondance élevée d’agents pathogènes opportunistes et une capacité renforcée de biosynthèse des nucléotides et des acides aminés et de métabolisme des glucides (glycolyse) [9].
Le tractus gastro-intestinal humain abrite également en abondance des virus et des phages collectivement connus sous le nom de virome intestinal. Les patients Covid-19 avaient une sous-représentation du virus de la marbrure légère du piment (virus à ARN) et de multiples lignées de bactériophages (virus à ADN) ainsi qu’un enrichissement en virus à ADN eucaryotes issus de l’environnement dans les échantillons fécaux comparativement aux patients non-Covid-19 (Figure 1) [10]. Le virome fécal dans l’infection au SARS-CoV-2 montrait une augmentation de la capacité de codage des gènes associés au stress, à l’inflammation et à la virulence. Initialement (lors de l’hospitalisation du patient), l’abondance fécale du virus à ARN, le virus des taches chlorotiques du piment et de multiples espèces de bactériophages étaient inversement corrélés à la sévérité de la Covid-19. Ces virus étaient également inversement associés aux taux sanguins de protéines pro-inflammatoires, de globules blancs et de neutrophiles, indiquant que les virus intestinaux pourraient adapter la réponse immunitaire de l’hôte à l’infection au SARSCoV- 2. Parmi les espèces de virus à ADN associées à la sévérité de la Covid-19, 40 % ont montré une corrélation inverse avec l’âge, ce qui pourrait étayer l’observation selon laquelle les sujets âgés présentent un risque plus élevé de développer une forme plus sévère de la Covid-19.
Conclusion
En résumé, l’ensemble des preuves disponibles suggère que le MI humain (microbiote bactérien, mycobiome et virome) est altéré dans la Covid-19. Ce dérèglement persiste, y compris après la résolution de la maladie, ce qui fait potentiellement peser une menace à long terme pour la santé de l’hôte. La composition du microbiote intestinal est associée à la réponse immunitaire de l’hôte à l’infection au SARS-CoV-2 et à la sévérité de la Covid-19. Des recherches supplémentaires sont nécessaires pour explorer les effets à long terme de la Covid-19 et pour améliorer le MI et l’immunité de l’hôte face à cette pandémie virale sans précédent.






