L’analyse multi-omique longitudinale révèle des mécanismes spécifiques de sous-groupes de patients au cours du syndrome de l'intestin irritable
Article commenté - Rubrique Adulte
Par le Pr Harry Sokol
Gastro-entérologie et nutrition, Hôpital Saint-Antoine, Paris, France
Section grand public
Retrouvez ici votre espace dédié
en_sources_title
en_sources_text_start en_sources_text_end
Chapitres
A propos de cet article
Auteur
Commentaire de l’article original de Mars et al. Cell 2020
Le microbiome intestinal est impliqué dans de multiples troubles gastrointestinaux chroniques humains. Or le manque de symétrie entre les études animales et humaine et l’absence d’une vue multi-omique intégrée des changements physiologiques spécifiques à la maladie rendent la d étermination de son rôle difficile. Les auteurs ont intégré les données multi-omiques longitudinal es du microbiome intestinal, du métabolome, de l’épigénome de l’hôte et du transcriptome dans le contexte de la physiologie de l’hôte du syndrome de l’intestin irritable (SII). Ils ont identifié des variations de la composition et des fonctions microbiennes, spécifiques à des sous-types de SII et reliées à la symptomatologie. Un sous-ensemble de changements identifiés dans les métabolites microbiens correspond à des mécanismes physiologiques de l’hôte qui sont pertinents pour le SII. En compilant une succession de données, les auteurs ont identifié le métabolisme des purines comme une nouve lle voie du métabolisme hôte-microbiote dans le SII, avec une application thérapeutique potentielle. Cette étude souligne l’intérêt de l’échantillonnage longitudinal et de l’intégration de données multi-omiques complémentaires pour identifier les mécanismes fonctionnels qui peuvent servir de cibles thérapeutiques dans une stratégie de traitement globale des maladies intestinales chroniques [1].
Que sait-on déjà à ce sujet ?
Le syndrome de l’intestin irritable (SII) est un trouble répandu dans le monde caractérisé par une douleur ou un inconfort abdominal récurrent. Principalement observé chez les femmes, le SII est associé à des changements dans la forme ou la fréquence des selles ; et c’est leurs formes qui définiront les sous-types du SII : à constipation prédominante (SII-C), à diarrhée prédominante (SII-D) ou mixte (SII-M).
La pathogenèse du SII implique des modifications de la motilité gastro-intestinale, de la sécrétion intestinale, de l’hypersensibilité viscérale et de la perméabilité intestinale, qui peuvent toutes être modifiées par le microbiome intestinal [2]. De plus, les symptômes du SII sont affectés par le régime alimentaire, la génétique de l’hôte et l’environnement, qui sont également connus pour moduler le microbiome intestinal humain [2]. Les preuves expérimentales soutenant le rôle du microbiome intestinal dans le SII sont basées sur des expériences de transplantation du patient vers des souris gnotobiotiques où sont reproduit certains symptômes associés au SII-C et au SII-D (temps de transit, sensation de douleur, perméabilité intestinale…). Cependant, en l’absence de modèles animaux SII robustes des études sur l’homme sont nécessaires pour découvrir les interactions entre le microbiome intestinal et les voies pathologiques spécifiques à l’homme. Les études humaines sur le SII sont limitées par un échantillonnage transversal le plus souvent et un manque de stratification en sous-groupes de patients, ce qui se reflète par un manque de concordance des résultats obtenus dans le grand nombre d’études sur le microbiome [4].
L’influence bien décrite du transit gastro-intestinal sur le microbiome intestinal augmente encore la variabilité des études. En outre, le SII, comme d’autres troubles gastro-intestinaux chroniques, est caractérisé par des périodes de rémission et d’exacerbation des symptômes, et les échantillons transversaux ne tiennent donc pas compte de la variabilité temporelle de la maladie. Enfin, les différences inhérentes à la physiologie de l’hôte entre les études sur l’homme et l’animal ont été un obstacle à l’avancement de notre compréhension des rôles mécanistiques du microbiome intestinal dans le SII. Les auteurs ont réalisé une étude longitudinale dans des sous-groupes de patients avec SII, intégrant des mesures multi-omiques, y compris le métagénome microbien, le transcriptome de l’hôte et le méthylome avec évaluation des fonctions de l’hôte. Cela a permis d’identifier des mécanismes spécifiques au sous-type de SII, induits par un métabolisme microbien altéré, qui correspondait à des changements simultanés dans la physiologie de l’hôte.
Points Clés
- Les fonctions du microbiote intestinale sont altérées au cours du SII avec des différences entre SII-C et SII-D
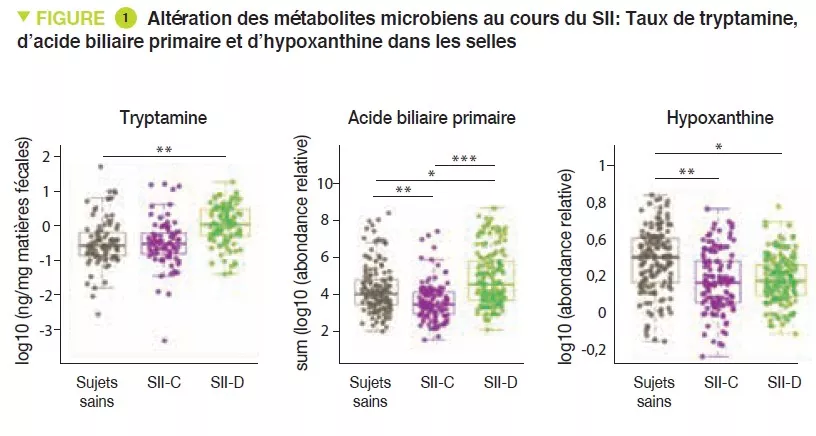
- L’augmentation de la production de tryptamine et la diminution de la transformation des acides biliaires pourraient jouer un rôle dans le SII-D
- Une surconsommation d’hypoxanthine par le microbiote et les cellules de l’hôte pourraient jouer un rôle dans le SII en altérant le niveau énergétique des cellules épithéliales intestinale
Quels sont les principaux résultats apportés par cette étude ?
Ici, les auteurs ont conduit une étude prospective observationnelle longitudinale avec analyse multi-omique portant sur le microbiome intestinal et l’hôte. Des sujets sains ont été comparés à des patients avec SII-C et SII-D. Un total de 77 participants ont fourni au moins un échantillon de selles (au total 474 échantillons de selles ont été obtenus), et 42 participants ont eu une sigmoïdoscopie permettant d’obtenir des biopsies du côlon. Pour identifier les facteurs microbiens déterminant les symptômes spécifiques des sous-types de SII, un séquençage métagénomique et une analyse métabolomique a été réalisée sur les échantillons de selles. Une analyse métabolomique et les mesures des cytokines ont été réalisées sur les échantillons de sérum. Enfin, un séquençage 16S, et des analyses du métabolome, du transcriptome et du méthylome ont été réalisées sur les biopsies coliques. Les auteurs ont identifié des différences dans la composition et la diversité du microbiote intestinal entre les sujets sains et les patients SII-C ou SII-D. L’analyse métabolomique des selles a révélé une augmentation de la tryptamine, un métabolite du tryptophane produit par certaines bactéries intestinales, chez les patients avec SII-D (Figure 1). La tryptamine ayant un effet d’accélération du transit par une action sur le récepteur à la sérotonine 5-HT4, pourrait ainsi jouer un rôle dans le phénotype de ces patients. De manière similaire, la proportion d’acide biliaire primaire était plus élevée chez les patients avec SII-D, témoignant d’un défaut de transformation par le microbiote. Des expériences in vitro suggéraient que les acides biliaires primaires augmentent la sécrétion colique et pourraient donc aussi participer au phénotype. Enfin, l’intégration des données multi-omiques a identifié un nouveau mécanisme potentiel dans le SII. Les résultats suggèrent qu’il existe chez les patients SII une dégradation accrue des nucléotides puriques, et notamment de l’hypoxanthine, par le microbiote et l’hôte, ce qui induit un stress au niveau colique. Cela conduirait à une réponse compensatrice avec augmentation de la récupération des purines. Les faibles niveaux de nucléotides puriques pourraient entraîner une diminution de l’état d’énergie épithéliale et de la capacité à réparer la muqueuse, pouvant en partie jouer un rôle dans la physiopathologie du SII.
Quelles conséquences en pratique ?
Ces données suggèrent un rôle du microbiote intestinal dans la physiopathologie du SII avec des différences entre le SII-C et le SII-D. D’autre part, ces résultats pointent vers le potentiel rôle d’un défaut en nucléotides puriques, notamment via une surconsommation d’hypoxanthine par le microbiote et les cellules de l’hôte. Ces résultats ouvrent la voie vers des traitements stimulant la production d’hypoxanthine microbienne ou inhibant la xanthine oxydase localement dans l’intestin.
Conclusion
Cette étude multi-omique longitudinale intégrée montre l’intérêt des études humaines longitudinales et met en lumières des altérations fonctionnelles du microbiote au cours du SII qui sont possiblement impliqué dans la physiopathologie. Les nouvelles pistes identifiées pourraient représenter de nouvelles cible thérapeutiques.






