ПРОДОЛЬНЫЙ МУЛЬТИОМНЫЙ АНАЛИЗ ВЫЯВИЛ СПЕЦИФИЧЕСКИЕ МЕХАНИЗМЫ, ЛЕЖАЩИЕ В ОСНОВЕ СИНДРОМ РАЗДРАЖЕННОГО КИШЕЧНИКА
РЕЦЕНЗИИ - РАЗДЕЛ, ПОСВЯЩЕННЫЙ ВЗРОСЛЫМ
Проф. Гарри Сокол (Harry Sokol)
Отделение гастроэнтерологии и нутрициологии, Больница Сен-Антуан, Париж, Франция
Раздел для широкой публики
Найдите здесь свое выделенное место
en_sources_title
en_sources_text_start en_sources_text_end
Делиться - значит заботиться
Возможно, эта тема заинтересует ваших коллег. Почему бы не поделиться ею?
Разделы
Об этой статье
Автор
Комментарий к оригинальной статье Mars EC al. Cell 2020 [1]
Микробиом кишечника имеет значение для развития многочисленных хронических желудочно-кишечные расстройства у людей. Однако определение его роли было затруднено отсутствием корреляции между исследованиями на животных и у людей, а также комплексного разностороннего взгляда на физиологические изменения, связанные с конкретным заболеванием. Авторы объединили продольные многокопийные данные кишечного микробиома, сведения о метаболитах, эпигеноме макроорганизма и транскриптоме в контексте физиологии синдрома раздраженного кишечника (СРК). Они определили специфические подтипы СРК и связанные с симптомами вариации состава и функции микробиоты. Ряд изменений микробных метаболитов соответствует физиологическим механизмам макроорганизма, имеющим отношение к СРК. Скомпилировав несколько уровней данных, авторы выделили метаболизм пуринов в качестве нового пути взаимодействия между макроорганизмом и микробиотой при СРК, обладающего потенциальной терапевтической значимостью. Это исследование подчеркивает ценность продольной выборки и интеграции комплементарных многокопийных данных для выявления функциональных механизмов, которые могут стать терапевтическими мишенями в будущей глобальной стратегии лечения хронических заболеваний кишечника.
ЧТО МЫ УЖЕ ЗНАЕМ?
Синдром раздраженного кишечника (СРК) — это распространенное во всем мире заболевание, которое характеризуется периодической болью или дискомфортом в животе. Возникая в основном у женщин, СРК связан с изменениями частоты и формы стула, при этом последняя определяет подгруппы СРК: СРК с преобладанием запора (СРК-З), СРК с преобладанием диареи (СРК-Д) или СРК смешанного типа (СРК-СТ).
Патогенез СРК включает изменения моторики желудочно-кишечного тракта, кишечной секреции, висцеральной гиперчувствительности и проницаемости кишечника — на все эти факторы могут влиять изменения микробиома кишечника [2]. Кроме того, на симптомы СРК влияют диета, генетика макроорганизма и окружающая среда, которые также модулируют микробиом кишечника человека [2].
Экспериментальные данные, подтверждающие роль кишечного микробиома в СРК, основаны на исследованиях трансплантации материала пациента мышам-гнотобиотам, в которых удалось воспроизвести определенные симптомы СРК-З и СРК-Д (время пассажа содержимого по кишечнику, болевые ощущения, кишечная проницаемость...) [3]. Поскольку надежные животные модели СРК отсутствуют, для определения взаимодействия между микробиомом кишечника и патологическими путями, специфичными для человека, необходимы исследования у людей. Исследования СРК у людей в целом ограничены использованием поперечной выборки и невозможностью стратификации на подгруппы, что отражается в несогласованности результатов, полученных в большом количестве исследований микробиома [4]. Хорошо описанное влияние пассажа содержимого по желудочно-кишечному тракту на микробиом кишечника еще больше увеличивает вариабельность исследований. Кроме того, СРК, как и другие хронические желудочно-кишечные расстройства, характеризуется периодами ремиссии и обострений, а при поперечном сборе данных не учитываются колебания заболевания во времени. Наконец, неотъемлемые различия в физиологии людей и животных были препятствием для прогресса в нашем понимании механистических ролей микробиома кишечника в развитии СРК. Авторы выполнили продольное исследование в подгруппах пациентов с СРК, интегрировав мультиомные измерения, включающие микробный метагеном, транскриптом макроорганизма и метилом, с оценкой функций клеток макроорганизма.
Это позволило выявить механизмы, специфичные для подгрупп СРК, индуцированные нарушением метаболизма микробиоты, которые сопутствовали одновременным изменениям в физиологии макроорганизма.
КЛЮЧЕВЫЕ МОМЕНТЫ
-
Функции кишечной микробиоты нарушены при СРК с различиями между СРК-З и СРК-Д
-
В развитии СРК-Д могут играть роль увеличение продукции триптамина и снижение трансформации желчных кислот
-
Чрезмерное потребление гипоксантина микробиотой и клетками макроорганизма может быть связано с СРК за счет изменения уровня энергии клеток эпителия слизистой оболочки кишечника.
ГЛАВНОЕ В ЭТОМ ИССЛЕДОВАНИИ?
Авторы провели проспективное обсервационное продольное исследование с мультиомным анализом микробиома кишечника и клеток макроорганизма. Здоровых участников сравнивали с пациентами с СРК-З и СРК-Д. В общей сложности 77 участников сдали по меньшей мере один образец кала (всего получено 474 образца кала), а 42 участника прошли ректороманоскопию, которая позволила выполнить биопсию толстой кишки. Чтобы идентифицировать микробные факторы, вызывающие симптомы, специфичные для каждого из подтипов СРК, выполняли метагеномное секвенирование и метаболомный анализ образцов кала. Также проводили метаболомный анализ и анализ цитокинов с использованием образцов сыворотки. Наконец, выполняли 16S-секвенирование, а также метаболомный, транскриптомный и метиломный анализы биоптатов толстой кишки.
Авторы выявили различия в составе и разнообразии микробиоты кишечника между здоровыми участниками и пациентами с СРК-З или СРК-Д.
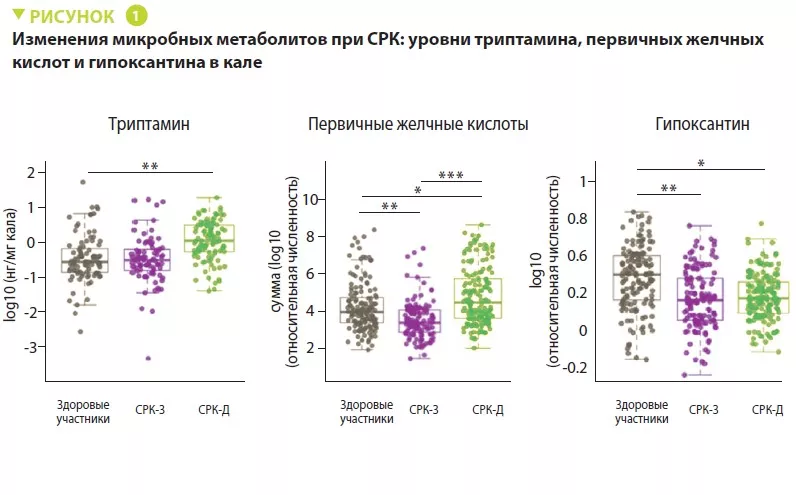
Метаболомный анализ кала позволил обнаружить у пациентов с СРК-Д повышенный уровень триптамина — метаболита триптофана, продуцируемого некоторыми кишечными бактериями (рисунок 1). Поскольку триптамин ускоряет пассаж содержимого кишечника из-за действия на серотониновые рецепторы 5-HT4, предполагают, что он может играть роль в формировании фенотипа этих пациентов. Кроме того, у пациентов с СРК-Д была больше доля первичных желчных кислот, что является признаком нарушения трансформации желчных кислот микробиотой. Эксперименты in vitro свидетельствуют, что первичные желчные кислоты усиливают секрецию в толстой кишке и также могут участвовать в формировании фенотипа.
Наконец, интеграция мультиомных данных выявила потенциальный новый механизм развития СРК. Результаты показывают, что у пациентов с СРК наблюдается усиленная деградация пуриновых нуклеотидов, в частности гипоксантина, микробиотой и клетками макроорганизма, что вызывает стресс толстой кишки. Предполагают, что это может приводить к компенсаторной реакции с увеличением синтеза пуринов. Низкие уровни пуриновых нуклеотидов способны ослабить поступление энергии в эпителий слизистой оболочки и снизить ее репаративную способность, что может вносить частичный вклад в патофизиологию СРК.
КАКОВЫ ПРАКТИЧЕСКИЕ ПОСЛЕДСТВИЯ?
Эти данные предполагают роль микробиоты кишечника в патофизиологии СРК с различиями между СРК-З и СРК-Д. Более того, они указывают на потенциальную роль дефицита пуриновых нуклеотидов, в частности вследствие чрезмерного потребления гипоксантина микробиотой и клетками макроорганизма. Полученные результаты указывают путь к лечению, стимулирующему выработку гипоксантина микроорганизмами или локально ингибирующему ксантиноксидазу в кишечнике.
ЗАКЛЮЧЕНИЕ
Это исследование с интегрированной мультиомикой показывает ценность продольных исследований у человека и подчеркивает функциональные изменения микробиоты при СРК, которые потенциально могут играть роль в патофизиологии этого заболевания. Выявленные звенья патогенеза могут стать новыми терапевтическими мишенями.








