ПЕРЕКРЕСТНОЕ ВЗАИМОДЕЙСТВИЕ МЕЖДУ МИКРОБИОТОЙ КИШЕЧНИКА И ИММУННОЙ СИСТЕМОЙ В БОРЬБЕ С ИНФЕКЦИЯМИ
ОБЗОРНАЯ СТАТЬЯ
Д-р Дорота Черука (Dorota Czerucka)
Группа по изучению медицинской биологии, экосистем и иммунитета, Научный центр Монако
Раздел для широкой публики
Найдите здесь свое выделенное место
en_sources_title
en_sources_text_start en_sources_text_end
Делиться - значит заботиться
Возможно, эта тема заинтересует ваших коллег. Почему бы не поделиться ею?
Разделы
Об этой статье
Автор
Живые существа миллионы лет эволюционировали в сложной среде, богатой микробными экосистемами, сформировав
симбиотические отношения, регулируемые иммунной системой. Новые методики секвенирования произвели революцию в наших представлениях об организме и показали, что микробиота каждого человека уникальна. Также полученные сведения пролили свет на роль микробиоты в физиологии макроорганизма и патологии многих заболеваний, в частности инфекционных. Взаимодействие между микробиотой кишечника и иммунной системой начинается еще во внутриутробной жизни. Взаимный и постоянный обмен между ними формирует иммунитет макроорганизма и состав микробиоты кишечника, обеспечивая защиту от инфекций и многих других заболеваний. Действительно, специфическая организация микробиоты, отделенной от хозяина всего одним слоем клеток, представляет собой особый вызов для иммунной системы, роль которой заключается в распознавании «чужого» как потенциального признака инфекции и запуске каскадов иммунных реакций. По этой причине постоянный обмен с микробиотой оказывает значительное влияние на иммунную систему макроорганизма. Иммунный ответ, который должен быть толерантным к микробиоте, в свою очередь, влияет на ее функцию и состав.
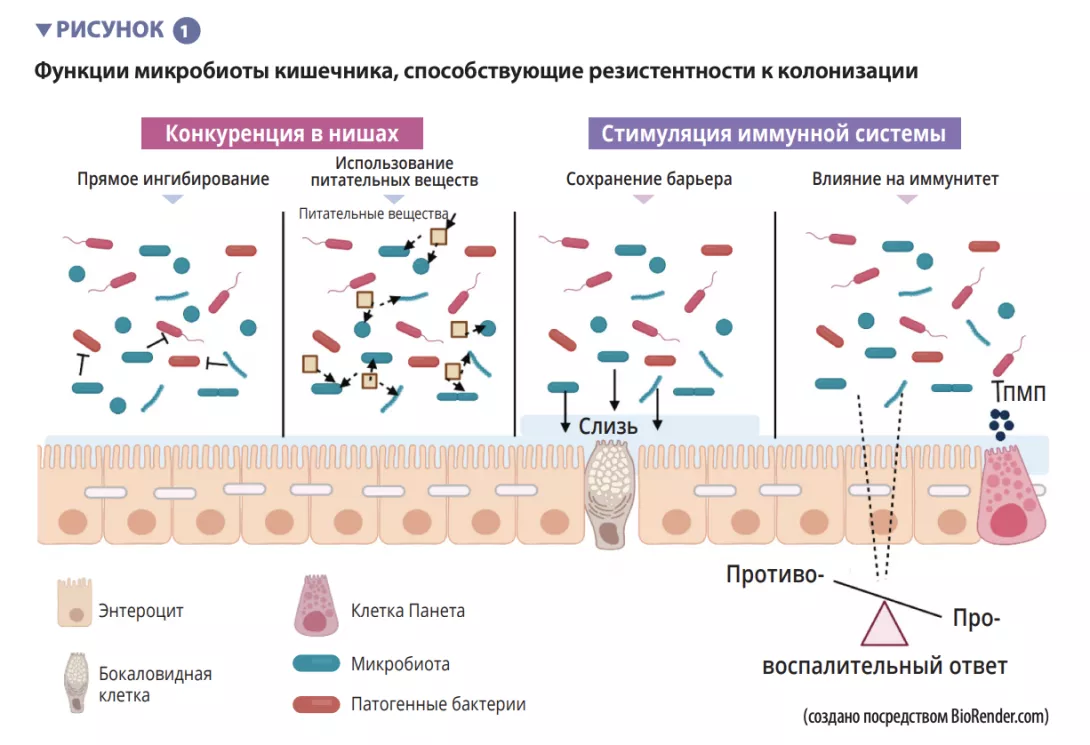
МИКРОБИОТА КИШЕЧНИКА И КИШЕЧНЫЙ БАРЬЕР
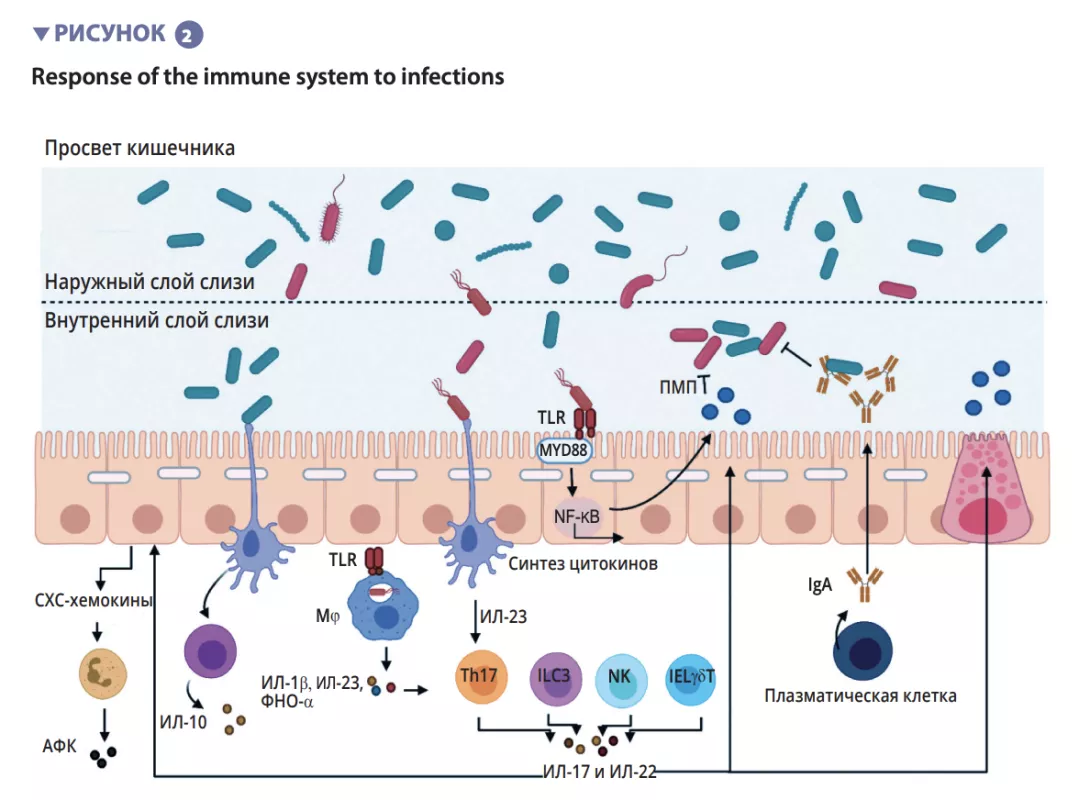
Микробиота кишечника — это начальный барьер, защищающий слизистую оболочку кишечника от патогенов. Эта
сложная экосистема населяет желудочно- кишечный тракт, в котором она остается стабильной и ограничивает доступ к кишечным нишам и питательным вещес твам, необходимым для размножения экзогенных бактерий, посредством явления, называемого «резистентность к колонизации» [1] (рисунок 1). Энтероциты, которые формирует физический барьер между просветом кишечника и тканями макроорганизма, поглощают воду и питательные вещества и секретируют противомикробные пептиды — ПМП (Reglllγ, β-дефенсины и кателицидин) [ 2 ] . Б лагодаря распознаванию микробных молекулярных паттернов (MПМП) специфическими рецепторами (включая toll-подобные рецепторы, TLR) эти клетки могут передавать сигнал цитокинам и хемокинам об инфекции и рекрутировать иммунные клетки (рисунок 2). Клетки Панета также участвуют в реализации резистентности к колонизации, секретируя ПМП (лизоцим, α-дефенсины, Reglllγ) [2].
Бокаловидные клетки, секретирующие с л и з ь , и М - к л е тк и о б л а д а ю т ко н тро л ирующим де й с т в и ем,
транспортируя антигены, интактные и захваченные случайным образом в просвете кишечника у комменсальных бактерий, патогенов или пищевых продуктов.
Затем они проходят процессинг в дендритных клетках (ДК) и презентацию адаптивной иммунной системе. Эта
функция жизненно важна для кишечной толерантности и индукции иммунных реакций слизистых оболочек [2], поэтому постоянно поддерживается баланс между про- и противовоспалительными ответами (рисунок 2). В частности, это продемонстрировано на моделях индуцированного колита у мышей и на мышах с дефицитом TLR: отсутствие микробиоты или ее распознавания подавляет пролиферацию эпителиальных клеток кишечника или восстановление барьера [2]. Наконец, слизь также обеспечивает защиту, улавливая ПМП, которые препятствуют проникновению патогенов в эпителий. В модели мышей с дефицитом Muc2 (Muc2 — это ген, кодирующий один из белков, образующих слизь) наблюдается усиление транслокации комменсальных бактерий и развиваются воспалительные заболевания кишечника [3].
Протягивая свои отростки между эпителиальными клетками, ДК способны фагоцитировать бактерии, присутствующие в просвете кишечника. Затем эти комменсальные бактерии транспортируются в мезентериальные лимфатические узлы, индуцируя продукцию IgA, секретируемого плазматическими клетками [1].
Врожденные лимфоидные клетки (ILC) также играют важную роль в гомеостазе кишечника ввиду их способности инициировать и направлять иммунные реакции кишечника. В частности, ILC типа 3 (ILC3) занимают уникальное место во взаимодействии с микробиотой кишечника. Синтезируя ИЛ-22, они стимулируют продукцию слизи, ПМП и секрецию хемокинов, а также рекрутинг полиморфноядерных (ПМЯ) клеток (рисунок 2) [1].
ПЕРЕКРЕСТНОЕ ВЗАИМОДЕЙСТВИЕ МЕЖДУ МИКРОБИОТОЙ КИШЕЧНИКА И ВРОЖДЕННОЙ ИММУННОЙ СИСТЕМОЙ
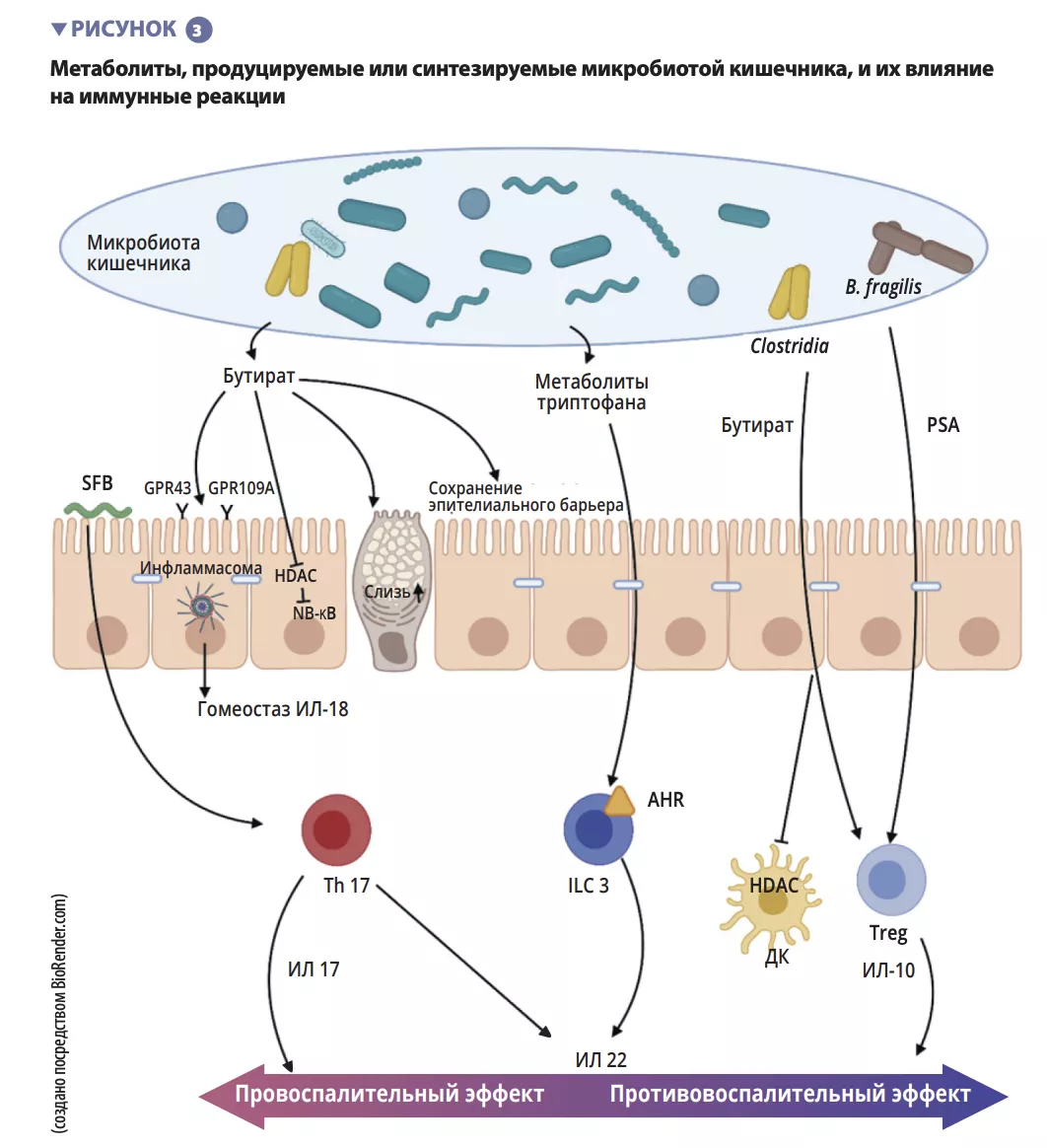
Среди компонентов врожденной иммунной системы, которые участвуют в обеспечении гомеостаза кишечника, основную роль играют антигенпрезентирующие клетки (АПК), такие как макрофаги (Mφ) и ДК. Mφ и ДК синтезируют ИЛ-10, таким образом способствуя дифференцировке Treg [4] и созреванию Th17-лимфоцитов при участии комменсальных бактерий: сегментированных нитчатых бактерий (SFB).
Они обладают особой способностью фиксироваться к эпителиальным клеткам кишечника, вызывая активную стимуляцию иммунной системы [5] (рисунок 3). Исследование показывает, что колонизация мышей этими SFB вызывает дифференцировку Th17, которая обеспечивает защиту от Citrobacter rodentium (мышиный эквивалент EPEC и EHEC). Высказано предположение, что эта защита обусловлена способностью SFB индуцировать стимуляцию синтеза Th17 ИЛ-22 — цитокина, который стимулирует продукцию ПМП [6].
ВЗАИМОДЕЙСТВИЕ МЕЖДУ МИКРОБИОТОЙ И АДАПТИВНОЙ ИММУННОЙ СИСТЕМОЙ
Окончательное созревание адаптивной иммунной системы характеризуется заселением слизистой оболочки кишечника зрелыми эффекторными Т-лимфоцитами с провоспалительными свойствами (Th17), Т-лимфоцитами с противовоспалительными свойствами (Treg) и В-лимфоцитами (рисунок 2). Помимо воздействия на макрофаги и дифференцировку Th17-клеток, SFB также стимулируют развитие лимфоидных фолликулов и участвуют в дифференцировке B-лимфоцитов в плазматические клетки, продуцирующие IgA, действие которого заключается в удержании патогенных бактерий в слизи [5]. Другие комменсальные бактерии также могут стимулировать адаптивные иммунные реакции: смесь 17 штаммов Clostridia, изолированная из образца кала человека и введенная мышам, вызывала противовоспалительный ответ, стимулируя Treg [7].
У Faecalibacterium prausnitzii также обнаружены противовоспалительные свойства in vitro и in vivo, опосредованные воздействием на фактор NF-κB, ДК и Mφ, которые секретируют ИЛ-10 и усиливают дифференцировку Treg в противовес Th17 [8]. Противовоспалительная активность описана и у Bacteroides fragilis и B. thetaiotaomicron. B fragilis синтезирует полисахарид A (PSA), который предотвращает продукцию провоспалительного ИЛ-17 и стимулирует секрецию противовоспалительного ИЛ-10 (рисунок 3). В специфической модели колита, индуцированного Helicobacter hepaticus, PSA стимулировал развитие лимфоидных фолликулов и Treg-лимфоциты, защищая организм мышей [9].
МИКРОБНЫЕ МЕТАБОЛИТЫ: ВАЖНЫЕ МЕДИАТОРЫ ПЕРЕКРЕСТНОГО ВЗАИМОДЕЙСТВИЯ МЕЖДУ МИКРОБИОТОЙ И АДАПТИВНЫМ ИММУНИТЕТОМ
Короткоцепочечные жирные кислоты (КЧЖК), метаболиты триптофана и соли желчных кислот являются основными метаболитами, продуцируемыми микробиотой кишечника, которые обеспечивают защиту от инфекций [9, 10]. Известно, что бутират, пропионат и сукцинат действуют на гомеостаз кишечника, секрецию слизи, а также различные клетки иммунной системы. Помимо прочего, бутират обладает противовоспалительным и противомикробным действием. Оно реализуется посредством рецепторов, связанных с G-белком (GPR), обнаруженных на эпителиальных клетках и макрофагах [9]. Бактерии F. prausnitzii как раз продуцируют большое количество бутирата, что частично может объяснить их противовоспалительный эффект. Бутират инактивирует NF-κB и, таким образом, подавляет синтез энтероцитами провоспалительных цитокинов ИФН-γ, ФНО-α, ИЛ-1β, ИЛ-8 [8] (рисунок 3). Он также индуцирует метаболические и эпигенетические модификации (посредством гистондеацетилаз, HDAC) макрофагов у мышей, тем самым усиливая их противомикробную активность in vitro и in vivo [11]. Комменсальные бактерии также могут метаболизировать триптофан и продуцировать противомикробные вещества. Примером являются Lactobacilli, использующие его в качестве источника энергии для синтеза индола, который связывается с арилуглеводородными рецепторами (AhR), присутствующими на ILC3. AhR запускают продукцию ИЛ-22 ILC, что дополнительно стимулирует секрецию ПМП и защищает от инфекций [9].
ПЕРЕКРЕСТНОЕ ВЗАИМОДЕЙСТВИЕ МИКРОБИОТЫ И КИШЕЧНОЙ ИММУННОЙ СИСТЕМЫ ДЛЯ ЗАЩИТЫ ОТ ВИРУСНЫХ ИНФЕКЦИЙ
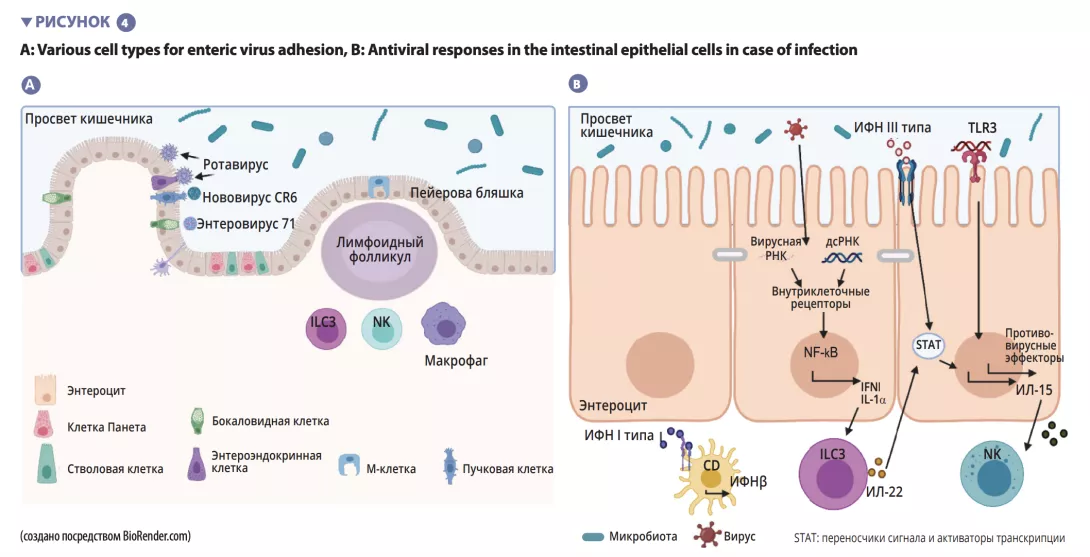
Основными причинами вирусного гастроэнтерита являются норовирус и ротавирус [12]. Кишечные вирусы инфицируют различные типы клеток: энтеровирус 71 специфически инфицирует бокаловидные клетки, тогда как ротавирус преимущественно тропен к энтероцитам [13] (рисунок 4A). Микробиота кишечника выступает в качестве барьера на пути кишечных вирусных инфекций. Вирусы эволюционировали и адаптировались к макроорганизму, реализуя механизмы, которые позволяют им преодолевать кишечный барьер и избегать барьерного иммунитета: эффективно перорально инфицировать мышей кишечными вирусами человека довольно сложно [13]. Проникновение вируса в энтероцит вызывает секрецию интерферона III типа (ИФН).
Обнаружение вируса может индуцировать синтез ИЛ-lα, который активирует продукцию ИЛ-22 ILC3. Этот ИЛ защищает от кишечных вирусных инфекций и действует синергически с ИФН III типа, обусловливая экспрессию противовирусных эффекторов и ИЛ-15. Распознавание вируса TLR-3 приводит к активации пути NF-κB, а также к продукции ИЛ-15, который активирует цитотоксические лимфоциты (NK-клетки). Вирусы, преодолевшие кишечный барьер, запускают продукцию ИФН I типа макрофагами собственной пластинки (рисунок 4B). Некоторые кишечные вирусы (ротавирус, реовирус, энтеровирус) способны прикрепляться к кишечным бактериям, что облегчает их проникновение в эпителиальные клетки кишечника [13]. SFB, которые ускоряют обновление эпителиальных клеток, обеспечивают защиту от ротавирусной инфекции у мышей путем элиминации инфицированных клеток [14]. Желчные кислоты, метаболизируемые микробиотой кишечника, также защищают тонкую (но не толстую) кишку от острой норовирусной инфекции у мышей, увеличивая выработку интерферона III типа в тонкой кишке [15].
ЗАКЛЮЧЕНИЕ
Изучение взаимосвязи между микробиотой кишечника и кишечным иммунным ответом — это большой шаг вперед в гастроэнтерологических исследованиях. Кишечный гомеостаз поддерживается за счет распознавания комменсальных бактерий клетками врожденной иммунной системы и клетками кишечного эпителия либо посредством прямого контакта (в случае SFB), либо в результате синтеза метаболитов микробиотой. Нарушение гомеостаза (дисбиоз кишечника, инфекции и т. д.) вызывает стимуляцию врожденных реакций и активацию адаптивной иммунной системы. Неэффективное «управление» воспалением может привести к возникновению заболевания, например, постинфекционного синдрома раздраженного кишечника.
1. Perez-Lopez A, Behnsen J, Nuccio SP, Raffatellu M. Mucosal immunity to pathogenic intestinal bacteria. Nat Rev Immunol 2016 ; 16 : 135-48.
2. Allaire JM, Crowley SM, Law HT, et al. The intestinal epithelium: central coordinator of mucosal immunity. Trends Immunol 2018 ; 39 : 677-96.
3. Van der Sluis M, De Koning BA, De Bruijn AC, et al. Muc2-deficient mice spontaneously develop colitis, indicating that MUC2 is critical for colonic protection. Gastroenterology 2006 ; 131 : 117-29.
4. Kim M, Hill A A, Wu WJ, et al. Intestinal microbes direct CX3CR1+ cells to balance intestinal immunity. Gut Microbes 2018 ; 17 : 151-63.
5. Flanningan KL, Denning TL. Segmented filamentous bacteria-induced immune responses: a balancing act between host protection and autoimmunity. Immunology 2018 ; 154 : 537-46.
6. Ivanov I I, Atarashi K, Manel N, et al. Induction of intestinal Th17 cells by segmented filamentous bacteria. Cell 2009 ; 139 : 485-98.
7. Atarashi K, Tanoue T, Oshima K, et al. Treg induction by rationally selected mixture of Clostridia strains from the human microbiota. Nature 2013 ; 500 : 232-6.
8. Miquel S, Martin R, Rossi O, et al. Faecalibacterium prausnitzi and human intestinal health. Curr Opin Microbiol 2013 ; 16 : 255- 61.
9. Levy M, Blacher E, Elinav E. Microbiome, metabolites and host immunity. Curr Opin Microbiol 2017 ; 35 : 8-15.
10. Michaudel C, Sokol H. The gut microbiota at the service of immunometabolism. Cell Metabolism 2020 ; 32 : 514-23.
11. Schulthess J, Pandey S, Capitani S, et al. The short Chain Fatty Acid Butyrate imprints an antimicrobial program in macrophages. Immunity 2019 ; 50 : 432-45.
12. Bányai K, Estes MK, Martella V, et al. Viral gastroenteritis. Lancet 2018 ; 392 : 175-86.
13. Segrist E, Cherry S. Using diverse model systems to define intestinal epithelial defenses to enteric viral infections. Cell Host Microbe 2020 ; 27 : 329-44.
14. Shi Z, Zou J, Zhang Z, et al. Segmented filamentous bacteria prevent and cure rotavirus infection. Cell 2019 ; 179 : 644-658.e13.
15. Grau KR, Zhu S, Peterson ST, et al. The intestinal regionalization of acute norovirus infection is regulated by the microbiota via bile acid-mediated priming of type III interferon. Nat Microbiol 2020 ; 5 : 84-92.








