COVID-19 И МИКРОБИОТА КИШЕЧНИКА
ОБЗОРНАЯ СТАТЬЯ
Проф. Тао Зуо (Tao Zuo)
Научно-исследовательский институт SYSU Институт гастроэнтерологии провинции Гуандун, Шестая аффилированная больница Университета Сунь Ят-Сена, Гуанчжоу, Китай
Раздел для широкой публики
Найдите здесь свое выделенное место
en_sources_title
en_sources_text_start en_sources_text_end
Делиться - значит заботиться
Возможно, эта тема заинтересует ваших коллег. Почему бы не поделиться ею?
Разделы
Об этой статье
Автор
Микробиота кишечника, включая ее бактериальную, грибковую и вирусную фракции, совместно заселяет кишечник человека и регулирует иммунитет макроорганизма к патогенным инвазиям. Крайне гетерогенные составы микробиоты кишечника (МК) у разных людей могут влиять на иммунные ответы макроорганизма на инфекцию, вызванную SARS-CoV-2, что обусловливает различия в симптомах и исходах Covid-19. С другой стороны, хотя инфекция, вызванная SARS-CoV-2, в первую очередь имеет респираторные симптомы, она серьезно нарушает регуляцию системного иммунитета макроорганизма и влияет на желудочно-кишечный тракт, т. е. может затрагивать микробиоту как в краткосрочной, так и в долгосрочной перспективе. Далее рассматриваются текущие данные по влиянию Covid-19 на МК человека, а также связи между составом МК и тяжестью Covid-19.
Covid-19 — это респираторное заболевание, вызываемое коронавирусом нового типа (SARS-CoV-2), им болеют десятки миллионов людей в мире. Хотя у большинства пациентов с Covid-19 наблюдаются
респираторные симптомы, у ≤20% из них присутствуют симптомы со стороны желудочно-кишечного тракта (ЖКТ), включая диарею [1], что позволяет предположить, что пищеварительный тракт является внелегочной локализацией проявлений заболевания и самой инфекции, вызываемой SARS-CoV-2. Кроме того, для Covid-19 характерен широкий спектр степени заболевания: от бессимптомной, легкой до тяжелой и критической, приводящей к дыхательной недостаточности и даже смерти [2]. Желудочно-кишечный тракт — крупнейший орган иммунной системы человека, играющий критически важную роль в защите макроорганизма от инфекций. Триллионы микроорганизмов колонизируют кишечник человека — бактерии, грибки, вирусы и другие формы жизни, известные под общим названием «микробиота» — и регулируют иммунитет макроорганизма.
Таким образом, чрезвычайно важно понять, влияет ли микробиота кишечника на восприимчивость к инфекции, вызванной SARS-CoV-2, и ее тяжесть, а также какое действие инфекция оказывает на МК и вследствие этого — на здоровье человека в долгосрочной перспективе.
БАКТЕРИАЛЬНАЯ МИКРОБИОТА КИШЕЧНИКА И COVID-19
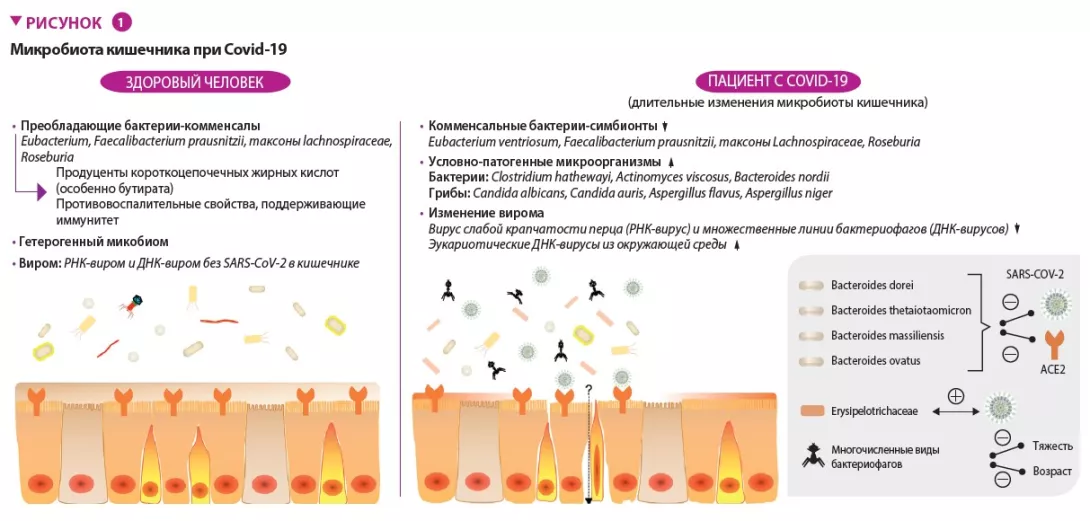
У пациентов с Covid-19 обнаружены значительные изменения бактериального микробиома кишечника по сравнению
со здоровыми людьми, которые характеризовались истощением полезных комменсалов и ростом активности
условно-патогенных микроорганизмов в кишечнике (рисунок 1) [3]. Истощение кишечных симбионтов сохранялось даже после разрешения Covid-19. Исходная (на момент госпитализации) численность бактерий Coprobacillus, Clostridium ramosum и Clostridium hathewayi имела положительную корреляцию с тяжестью Covid-19. Также обнаружена обратная корреляция между численностью бактерий Faecalibacterium prausnitzii (известных своими противовоспалительными свойствами) и тяжестью заболевания.
SARS-CoV-2 использует рецептор ангиотензинпревращающего фермента 2 (АПФ2) для проникновения в организм, и этот рецептор активно экспрессируется как в дыхательной системе, так и в желудочно- кишечном тракте [4]. АПФ2 важен для контроля воспаления и микробной экологии кишечника [5]. Сообщалось, что четыре вида Bacteroides — B. dorei, B. thetaiotaomicron, B. massiliensis и B. ovatus — обратно связаны с экспрессией АПФ2 в кишечнике мышей [6]. Интересно, что их содержание в фекальной микробиоте также обратно коррелировало с фекальной вирусной нагрузкой SARS-CoV-2 у пациентов с Covid-19 во время болезни. Эти данные свидетельствуют о том, что бактериальная МК человека подвержена влиянию Covid-19 и может «калибровать» защиту макроорганизма от инфекции, вызванной SARS-CoV-2.
ГРИБКОВЫЙ МИКРОБИОМ И COVID-19
В желудочно-кишечном тракте также обитает большое количество грибов, известных под общим названием микобиом (грибковый микробиом). Они участвуют в формировании МК и развитии иммунной системы [7].
У пациентов с Covid-19 также обнаружены изменения микобиомов кишечника, характеризующиеся обогащением Candida albicans и высокой гетерогенностью конфигураций (рисунок 1) [8]. Разнообразие фекального микобиома у пациентов с Covid-19 при выписке было в 2,5 раза выше, чем у здоровых людей. Оппортунистические грибковые патогены, Candida albicans, C. auris и Aspergillus flavus, были широко представлены в кале пациентов с Covid-19 во время болезни. Два грибковых патогена, ассоциированных с респираторными симптомами, A. flavus и A. niger, обнаруживали в образцах кала подгруппы пациентов с Covid-19 даже после разрешения болезни. Нестабильные микобиомы кишечника и длительный дисбиоз сохранялись примерно у 30% пациентов с Covid-19.
ВИРОМ КИШЕЧНИКА И COVID-19
Посредством секвенирования вирусной РНК методом «дробовика» обнаружены признаки активной вирусной кишечной инфекции у 47% пациентов с Covid-19 даже в отсутствии желудочно-кишечных симптомов и после респираторного клиренса SARS-CoV-2 [9], что свидетельствует о «латентной» инфекция желудочно-кишечного тракта и потенциальном риске фекально-оральной передачи.
У пациентов с такой желудочно-кишечной активностью SARS-CoV-2 обнаруживаются аномалии состава и функций МК, характеризующиеся высоким содержанием условно-патогенных микроорганизмов и повышенной способностью к биосинтезу нуклеотидов и аминокислот, а также к метаболизму углеводов (гликолизу) [9]. Желудочно-кишечный тракт человека содержит и множество вирусов/фагов, известных под общим названием «кишечный виром». В образцах кала пациентов с Covid-19 имело место недостаточное содержание вируса слабой крапчатости перца (РНК-вирус) и множественных линий бактериофагов (ДНК- вирусы), а также увеличение содержания эукариотических ДНК-вирусов окружающей среды по сравнению с лицами без Covid-19 (рисунок 1) [10]. Фекальный виром при инфекции, вызванной SARS-CoV-2, характеризуется большими возможностями кодирования генов, связанных со стрессом, воспалением и вирулентностью. Исходно содержание РНК-вируса хлоротической пятнистости перца и нескольких видов бактериофагов обратно коррелировало с тяжестью Covid-19. Эти вирусы также обратно коррелировали с уровнями провоспалительных белков, лейкоцитов и нейтрофилов в крови. То есть получается, что вирусы, обитающие в кишечнике, могут настраивать иммунный ответ макроорганизма на инфекцию, вызванную SARS-CoV-2. Среди ДНК-вирусов, связанных с тяжестью Covid-19, 40% видов обратно коррелировали с возрастом, что может лежать в основе наблюдения, согласно которому пожилые люди подвержены более высокому риску более тяжелого течения Covid-19.
ЗАКЛЮЧЕНИЕ
Набор полученных данных свидетельствует о том, что при Covid-19 страдает МК человека (бактериальная микробиота, микобиом и виром). Такое нарушение регуляции сохраняется даже после разрешения заболевания, что потенциально представляет долгосрочную угрозу здоровью макроорганизма. Состав кишечной микробиоты связан с иммунными реакциями макроорганизма на SARSCoV-2 и тяжестью Covid-19. Для изучения долгосрочных эффектов Covid-19 и улучшения МК макроорганизма и иммунитета к этой беспрецедентной вирусной инфекции необходимы дальнейшие исследования.








