ВЛИЯНИЕ АНТИБИОТИКОВ НА МИКРОБИОТУ КИШЕЧНИКА. ВАЖНО ЛИ ЭТО?
ОБЗОРНАЯ СТАТЬЯ
Проф. Франсиско Гуарнер (Francisco Guarner)
Отдел исследований пищеварительной системы, Университетская клиника Валь д’Эброн, Барселона, Испания.
Раздел для широкой публики
Найдите здесь свое выделенное место
en_sources_title
en_sources_text_start en_sources_text_end
Делиться - значит заботиться
Возможно, эта тема заинтересует ваших коллег. Почему бы не поделиться ею?
Разделы

Об этой статье
Автор
Массовое неправильное применение антибиотиков может приводить не только к инфекциям, устойчивым к антибиотикам, но и к распространению неинфекционных хронических заболеваний. По сравнению с любыми другими медицинскими инновациями антибиотики и вакцины внесли больший вклад в увеличение продолжительности жизни. По мнению ведущих экспертов, на которых ссылается Британский медицинский журнал, открытие антибиотиков относится к ключевым медицинским событиям [1]. Внедрение мер по профилактике и лечению инфекционных заболеваний привело к кардинальным изменениям. Инфекции обычно являлись причиной 30% всех смертей, в основном детей до 5 лет, но в конце ХХ века эта цифра уменьшилась до 4% [1]. Однако недавно появились два фактора, вызывающих озабоченность. Во-первых, из-за развития резистентности снижается эффективность лечения все большего числа инфекций. Основной угрозой для здоровья человека сейчас является резистентность к антибиотикам, и у нас есть подтверждение ее связи с избыточным применением антибиотиков [2].
Во-вторых, антибиотики, предназначенные для уничтожения патогенных микроорганизмов, оказывают нежелательное воздействие на экосистему микробиоты человека, восстановление которой может потребовать много времени и усилий [3]. Человеческий организм является средой обитания сложного сообщества микроорганизмов, известного как микробиом или микробиота, которое играет важную роль в поддержании здоровья человека. В результате нарушения состава микробиоты и сопутствующей потери ее функциональных свойств люди, живущие в индустриальном обществе, могут лишиться набора бактерий, оптимального для поддержания здоровья [3]. Необходимо привлечь внимание к этой проблеме в рамках медицинского сообщества и выработать четкие инструкции со стороны органов управления здравоохранением.
ВЛИЯНИЕ МАССОВОГО ПРИМЕНЕНИЯ АНТИБИОТИКОВ
Согласно отчету ВОЗ за 2018 г. [2], общий объем антибиотиков, применяемых у человека, значительно превышает 6500 тонн в год (данные для 65 стран, без учета Китая и США). В среднем 18 из каждых 1000 человек ежедневно принимают определенную дозу антибиотика; это означает, что ежегодно люди принимают 139 миллионов доз. Это значение в африканских странах ниже (в среднем 12 на 1000 человек), чем в Европе (17,8) или Америке (18,2), при этом инфекции обусловливают до 36,6% всех случаев смерти в Африке и только 2,7% в Европе и 4,5% в Америке. В странах с низким доходом все еще наблюдается высокая смертность от инфекционных заболеваний при низкой частоте применения антибиотиков. Ограниченный доступ, ошибки в применении лекарственных средств или неправильные схемы лечения могут способствовать развитию в этих странах таких резистентных инфекций как, например, туберкулез. В развитых странах до половины всех назначений антибиотиков можно считать ненадлежащими [2].
Ненужный прием антибиотиков ускоряет развитие резистентности и вызывает рост доли штаммов Pseudomonas aeruginosa, Escherichia coli, Klebsiella pneumoniae, Staphylococcus aureus и т. д. с множественной лекарственной резистентностью [2].
ВЫЗЫВАЕМЫЙ АНТИБИОТИКАМИ ДИСБАКТЕРИОЗ
Хотя большинство схем применения антибиотиков не вызывают немедленных и явных побочных эффектов, многих специалистов беспокоит косвенный вред, выражающийся в нарушении состава и функций кишечной микробиоты [3]. Самым частым осложнением применения антибиотиков является вызываемая ими диарея, которая развивается у 15–25% пациентов. Большинство случаев вызванной антибиотиками диареи имеют легкое течение и проходят самостоятельно. Однако развивается все больше тяжелых форм заболевания, включая диарею, вызванную Clostridioides difficile. Вызываемые антибиотиками нарушения состава микробиоты способствуют созреванию спор C. difficile в кишечнике, избыточному росту вегетативных форм и продукции токсина, что приводит к повреждению эпителия и колиту. Клинические проявления колеблются от самоограничивающейся диареи до токсического мегаколона, фульми- нантного колита и смерти [4].
В первые 3 года после рождения у детей наблюдается быстрое увеличение разнообразия кишечной микробиоты, после чего она стабилизируется в состоянии, в котором существует у взрослых. По- сле этого основной состав микробиоты остается стабильным, однако может происходить колебание содержания бактерий в ответ на воздействие внешних факторов (диеты, лекарств, путешествий и т. д.). Исследования показали, что применение антибиотиков приводит к очень сильному сдвигу относительного содержания различных бактерий. У пациентов, принимавших β-лактамы или хинолоны, количество видов основных бактерий уменьшилось с 29 до 12, общее количество имеющихся видов бактерий уменьшилось на 25% и наблюдалась смена доминантного рода с Faecalibacterium на Bacteroides [5]
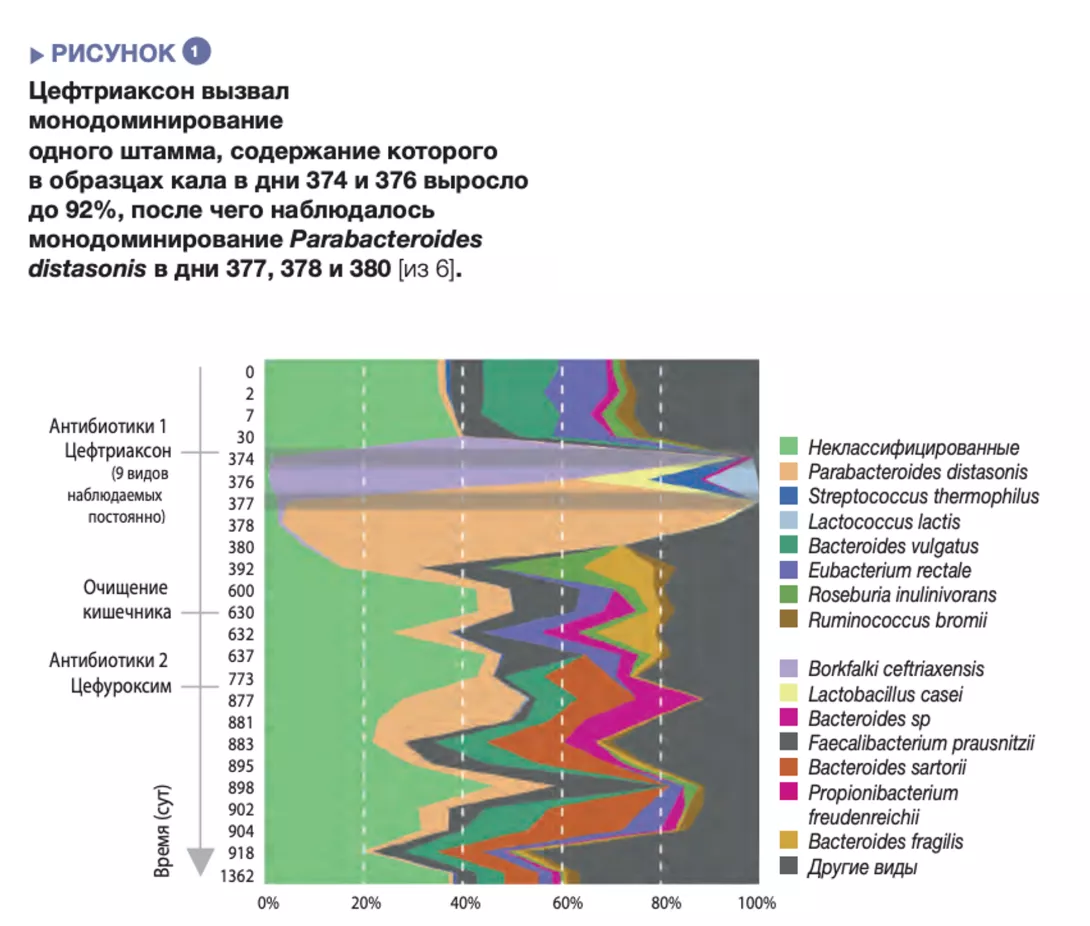
Прием анти- биотиков приводил к уменьшению разнообразия бактерий (обеднению экосистемы кишечника) и избыточному росту резистентных видов, что сопровождалось общим ростом микробной нагрузки, то есть увеличением количества бактерий в 1 г кала [5]. После внутривенного введения цефтриаксона описаны случаи исключительно сильного избыточного роста бактерий с монодоминированием одного штамма, относительное содержание в кале которого могло достигать 92% [6]. (рисунок 1).
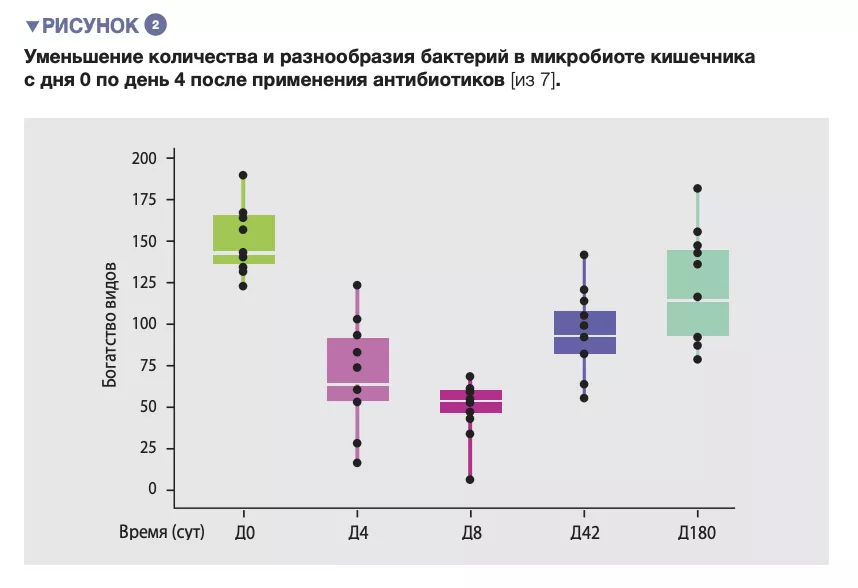
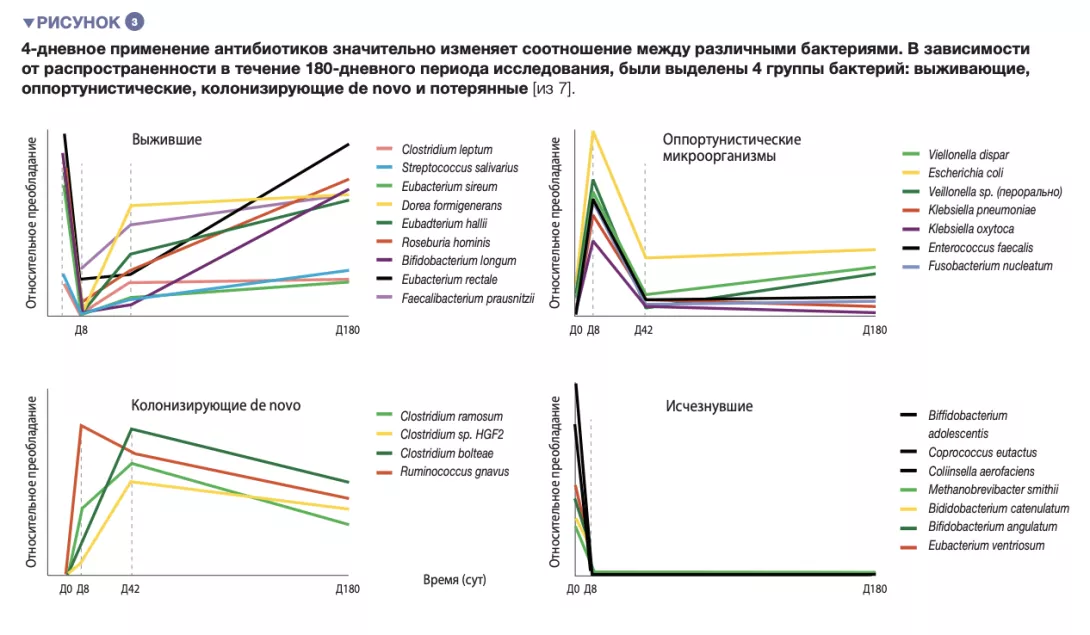
У здоровых добровольцев 4-дневное применение антибиотиков приводило к разрастанию энтеробактерий и других патогенных микроорганизмов (Enterococcus faecalis, Fusobacterium nucleatum) и снижению содержания видов Bifidobacterium и продуцентов бутирата [7]. Восстановление кишечной микробиоты до состояния, близкого к исходному, происходило только через 1,5 месяца, и даже через 180 дней в составе кала не удалось обнаружить 9 распространенных видов бактерий, которые имелись у всех участников до начала лечения (рисунки 2 и 3).
Дисбактериоз — это изменение состава и функций микробиоты, которое нарушает экосистему кишечника до такой степени, что снижаются ее защитные и адаптивные возможности [8]. Влияние антибиотиков на функции продуцентов короткоцепочечных жирных кислот (КЦЖК), в частности бутирата, может иметь долгосрочные последствия из-за нарушения симбиотического баланса между микробиотой и организмом хозяина. Неспособность синтезировать бутират усиливает поступление кислорода в слизистую оболочку и нарушает микроэкосистему. Это повышает выживаемость устойчивых к кислороду бактерий (энтеробактерий) и затрудняет восстановление продуцентов бутирата, например Faecalibacterium, которые являются строгими анаэробами [9]. Такие изменения критически влияют на способность экосистемы к адаптации и способствуют переходу дисбаланса в хроническую форму.
Нежелательное побочное влияние антибиотиков на микробиоту кишечника и сопутствующая потеря ее функциональных свойств могут привести к нарушению симбиотического баланса между микробиотой и организмом хозяина.
РЕЗИСТОМ
Резистом — это совокупность всех генов бактерий, прямо или опосредованно вносящих вклад в резистентность к антибиотикам. Гены резистентности, по-видимому, не подвергаются селекции в ответ на кратковременное воздействие антибиотика. Анти- биотики синтезируются уже сотни миллионов лет, и столько же лет существует резистентность к ним, но количество генов в резистоме отражает непрерывную совместную эволюцию продуцентов антибиотиков и организмов-мишеней.
Состав резистома и распространенность генов резистентности у бактерий человека адаптируются к действию факторов селекции, связанных с поведением человека. Виды, имеющие гены резистентности к β-лактамам, подвергаются положительной селекции во время и после применения антибиотиков [7]. Аналогичным образом наличие генов резистентности к аминогликозидам тоже повышает риск колонизации de novo. Носительство генов резистентности к антибиотикам влияет на процесс восстановления после применения антибиотиков [7].
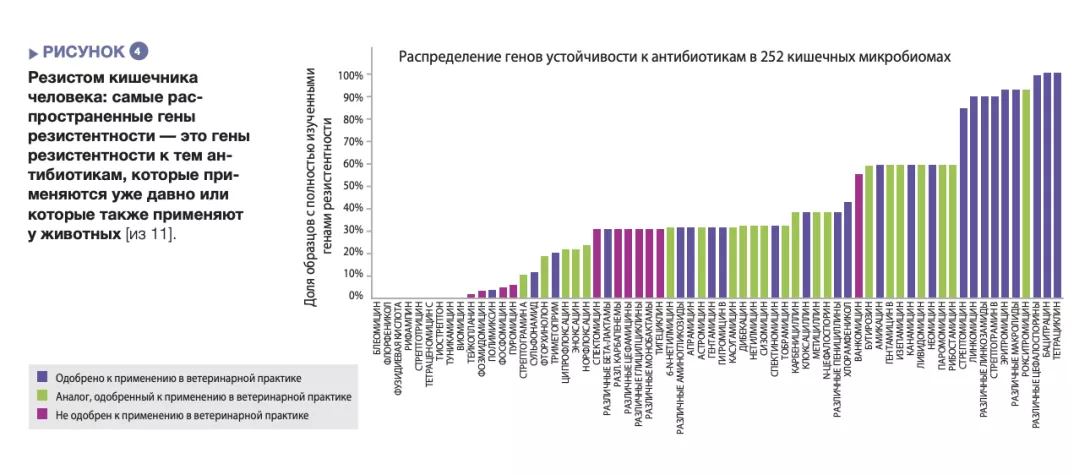
Микробиота кишечника человека содержит разнообразные гены резистентности к антибиотикам, которые можно изучить с помощью методов молекулярного секвенирования [10]. Исследование 252 образцов кала, полученных у людей из разных стран, показало, что самыми распространенными генами резистентности в микробиоте являются гены резистентности к антибиотикам, которые также применяются у животных, и к антибиотикам, применяемым уже достаточно долгое время (рисунок 4) [11]. Данные о применении антибиотиков у людей и животных в разных странах соответствуют различиям распространенности генов резистентности в этих странах. В совокупности эти данные позволяют предположить положительную корреляцию между уровнем применения антибиотиков и распространенностью генов резистентности к ним.
Некоторые гены резистентности к антибиотикам легко переходят от одних бактерий к другим при горизонтальной передаче генов. Исследования показали, что в условиях вызванного антибиотиками стресса рост оппортунистических бактерий приводит к распространению генов резистентности среди сообщества микроорганизмов. Долгосрочное исследование микробиоты кишечника финских детей показало, что прием антибиотиков способствует распространению генов резистентности к антибиотикам в кишечнике из-за избыточного роста бактерий, несущих эти гены, и усиления переноса генов резистентности посредством плазмид [12]. Максимальная распространенность генов резистентности к антибиотикам, переносимых хромосомами бактерий, достигает пика после приема антибиотика, после чего наблюдается резкий спад, в то время как распространенность генов резистентности, переносимых мобильными элементами, сохраняется длительное время после завершения антибактериальной терапии. Это можно объяснить тем, что эписомальные гены могут широко циркулировать между видами бактерий по механизму горизонтального переноса генов.
В условиях вызванного антибиотиками стресса рост оппортунистических бактерий приводит к распространению генов резистентности среди сообщества микроорганизмов кишечника. Микробиота кишечника человека является резервуаром генов резистентности, из которого они могут передаваться патогенам.
Микробиота кишечника человека может быть самым доступным для патогенов резервуаром генов резистентности. Применение антибиотиков в раннем возрасте сопровождается уменьшением разнообразия микробиоты и повышением риска развития резистентности к антибиотикам.
Пробиотики могут предотвращать избыточный рост резистентных видов бактерий в ходе лечения антибиотиками и свести к минимуму распространение генов резистентности к ним.
АНТИБИОТИКИ И РИСК ЗАБОЛЕВАНИЯ
Нарушение экосистемы микробиоты кишечника в раннем возрасте в сочетании с генетической предрасположенностью может оказывать долгосрочное влияние на иммунную систему, вызывая заболевания или предрасположенность к ним в более старшем возрасте. Действительно, было показано, что воспалительные заболевания кишечника (ВЗК), метаболические расстройства (сахарный диабет 2-го типа, ожирение) и атопические заболевания связаны с изменением состава микробиоты кишечника.
Ведущая гипотеза о патогенезе воспалительных заболеваний заключается в том, что воспаление запускается изменением состава микробиоты кишечника на фоне повторяющегося воздействия антибиотиков. Риск развития ВЗК у детей, получавших антибиотики в течение первого года жизни, в 5,5 раза выше, чем у детей, не получавших антибио- тиков [13]. Аналогично, применение антибиотиков в первые 2 года жизни, когда в организме ребенка развивается популяция адипоцитов, ассоциируется с последующим развитием детского ожирения [14]. Обеднение микробиоты кишечника сопровождается усилением накопления жира, резистентностью к инсулину и лептину и более выраженным воспалительным фенотипом.
ЗАКЛЮЧЕНИЕ
Несмотря на способность микробиоты кишечника к адаптации, в настоящее время распространение генов резистентности к антибиотикам представляет серьезную угрозу для здоровья людей, и основной причиной этого, по-видимому, является чрезмерное применение антибиотиков. Кроме того, появляется все больше данных, связывающих ослабление микробиоты жителей развитых стран с одновременным распространением неинфекционных хронических заболеваний [3]. Опятьтаки, ведущей причиной такого нарушения микробиоты является использование антибиотиков. Сдвиг существующих тенденций в сторону более стандартизированной медицинской практики является сложной задачей для здравоохранения ХХI века.
Без сомнения, ограниченное и рациональное применение антибиотиков является наилучшим и наиболее эффективным способом предотвращения нарушений состава микробиоты кишечника человека. Интересно, что применение пробиотиков с подтвержденной эффективностью с целью предотвращения антибиотикоассоциированной диареи позволяет сдержать избыточный рост резистентных видов бактерий в процессе применения антибиотиков [15]. Потенциально эта стратегия может свести к минимуму распространение генов резистентности к антибиотикам.