Impact des antibiotiques sur le microbiote intestinal : quelle importance ?
Synthèse
Par le Pr. Francisco Guarner
Unité de recherche sur le système digestif, Hôpital université Vall d’Hebron, Barcelone, Espagne
Section grand public
Retrouvez ici votre espace dédié
en_sources_title
en_sources_text_start en_sources_text_end
Chapitres

A propos de cet article
Auteur
Le mésusage massif des antibiotiques peut être à l’origine d’infections bactériennes multirésistantes, mais aussi de l’expansion de maladies chroniques non transmissibles. Les antibiotiques et les vaccins ont, plus que n’importe quelle autre innovation médicale, permis d’allonger l’espérance de vie. D’après des experts nommés par le British Medical Journal, les antibiotiques figurent parmi les découvertes médicales les plus reconnues[1]. L’introduction de mesures destinées à prévenir et à traiter les maladies infectieuses a donné lieu à des changements colossaux. En effet, les infections étaient auparavant à l’origine de 30 % des décès, principalement chez les enfants de moins de 5 ans ; à la fin du XXe siècle, elles étaient responsables de moins de 4 % de la mortalité seulement [1]. Cependant, deux gros sujets de préoccupation ont récemment surgi. Premièrement, les traitements d’un nombre croissant d’infections deviennent moins efficaces en raison d’une résistance aux antibiotiques. Ce phénomène constitue aujourd’hui une menace majeure pour la santé humaine, et son lien avec l’utilisation excessive des antibiotiques est bien documenté [2]. Deuxièmement, les antibiotiques, initialement destinés à détruire les micro-organismes pathogènes, ont des conséquences imprévues pour l’écosystème microbien humain, assorties de modifications qui sont parfois difficilement réversibles [3]. Le corps humain abrite un réseau complexe de micro-organismes appelé « microbiote », lequel joue un rôle important sur la santé. Du fait de l’altération du microbiote et de la perte de ses fonctions, les communautés microbiennes des personnes vivant dans les sociétés industrialisées pourraient s’avérer sous-optimales pour la santé [3]. La communauté médicale doit être sensibilisée à ces enjeux et les responsables des politiques de santé doivent formuler des recommandations claires dans ce domaine.
Impact du recours massif aux antibiotiques
D’après le rapport 2018 de l’OMS [2], la quantité totale d’antibiotiques consommée par l’homme dépasse largement les 6 500 tonnes par an (données de 65 pays, hors Chine et États-Unis). En moyenne, 18 personnes sur 1 000 prennent chaque jour une dose définie d’antibiotiques, ce qui correspond à 139 millions de doses par jour. Cette moyenne est plus faible dans les pays africains (12 ‰) qu’en Europe (17,8 ‰) ou en Amérique (18,2 ‰), alors que les infections sont responsables de 36,6 % des décès en Afrique, mais seulement de 2,7 % ou 4,5 % en Europe ou en Amérique respectivement. Les pays émergents affichent toujours des taux élevés de mortalité par maladies infectieuses, mais des taux faibles de recours aux antibiotiques. Dans ces pays, un accès limité et le recours à des médicaments inadaptés ou à de mauvais schémas thérapeutiques peuvent contribuer à l’émergence d’infections résistantes comme la tuberculose
Dans les pays développés, jusqu’à la moitié des prescriptions d’antibiotiques peuvent être considérées comme inutiles [2]. Ce phénomène accélère le développement des résistances, et des souches multirésistantes de Pseudomonas aeruginosa, Escherichia coli, Klebsiella pneumoniae, Staphylococcus aureus, etc., sont de plus en plus nombreuses [2].
Acclamés comme l'une des avancées majeures de la médecine du XXème siècle, les antibiotiques ont sauvé des millions de vies. Mais ils ont aussi un impact sur notre microbiote en provoquant des dysbioses. Examinons de plus près ce rôle ambivalent.
Le rôle ambivalent des antibiotiques
La dysbiose induite par les antibiotiques
Même si la plupart des antibiothérapies n’entraînent pas d’effets indésirables immédiats évidents, les dommages collatéraux sur la composition du microbiote intestinal et ses fonctions sont préoccupants [3]. La diarrhée constitue la complication la plus fréquemment associée aux antibiotiques et touche 15 à 25 % des patients. La plupart des diarrhées induites par les antibiotiques sont d’intensité légère et spontanément résolutives, mais de plus en plus de patients développent des formes plus sévères, notamment dues à Clostridioides difficile. Les troubles induits par les antibiotiques favorisent la germination des spores de C. difficile dans l’intestin, la prolifération de formes végétatives et la production de toxines, ce qui entraîne des lésions épithéliales et une colite. Le tableau clinique peut varier de diarrhées spontanément résolutives à un mégacôlon toxique ou une colite fulminante, voire au décès du patient [4].
Dès la naissance et pendant les trois premières années de vie, la diversité du microbiote intestinal augmente rapidement avant de se stabiliser vers un état « adulte ». Ensuite, l’essentiel de sa composition est stable, mais l’abondance de différentes bactéries peut fluctuer en réponse à des facteurs extérieurs (alimentation, médicaments, voyages, etc.). Des études ont montré que les antibiotiques provoquent des variations très importantes des abondances relatives. Dans le microbiote de patients sous β-lactamines ou quinolones, le nombre de taxa partagés par la plupart des sujets est passé de 29 à 12, le nombre total de taxa observés a diminué de 25 % et le genre dominant n’était plus Faecalibacterium, mais Bacteroides [5].
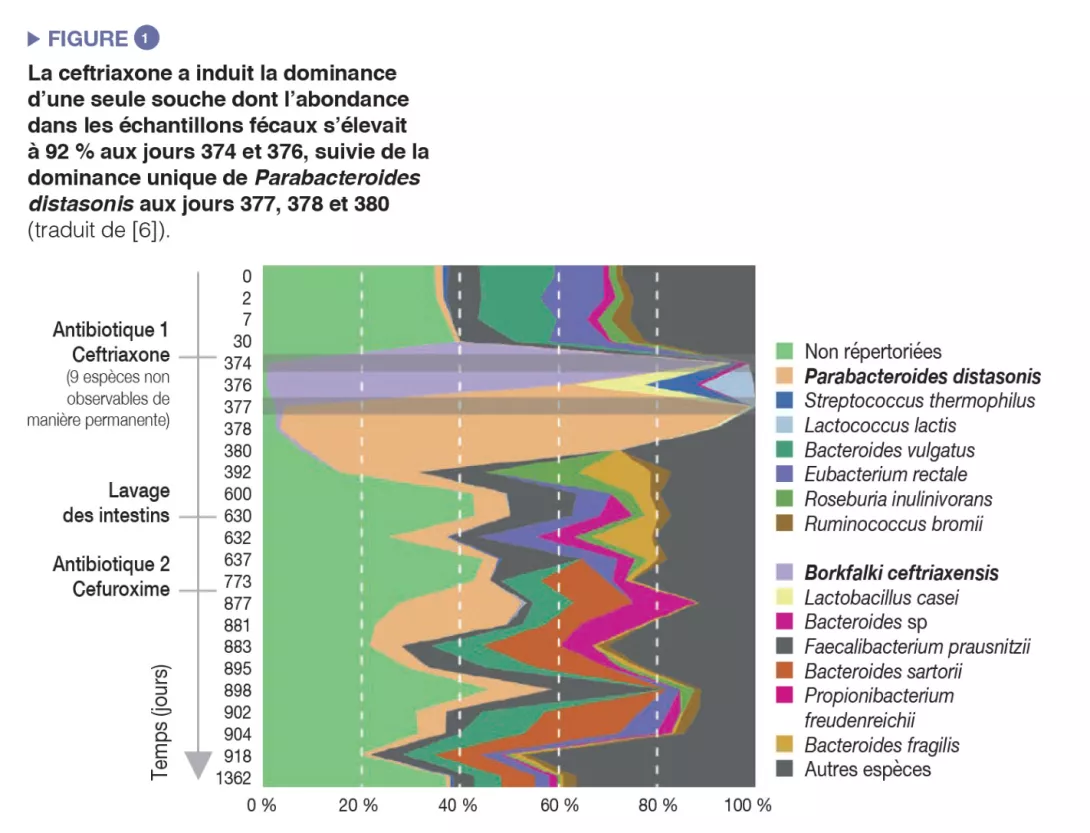
L’administration d’antibiotiques a induit une diminution de la diversité microbienne (perte de richesse de l’écosystème) et une prolifération d’espèces résistantes, ce qui a entraîné une augmentation globale de la charge microbienne (nombre de bactéries par gramme de selles) [5]. Des cas extrêmes de prolifération induite par les antibiotiques ont été rapportés : une souche unique peut devenir prédominante et atteindre une abondance relative de 92 % dans des échantillons fécaux après administration intraveineuse de ceftriaxone [6] (Figure 1).
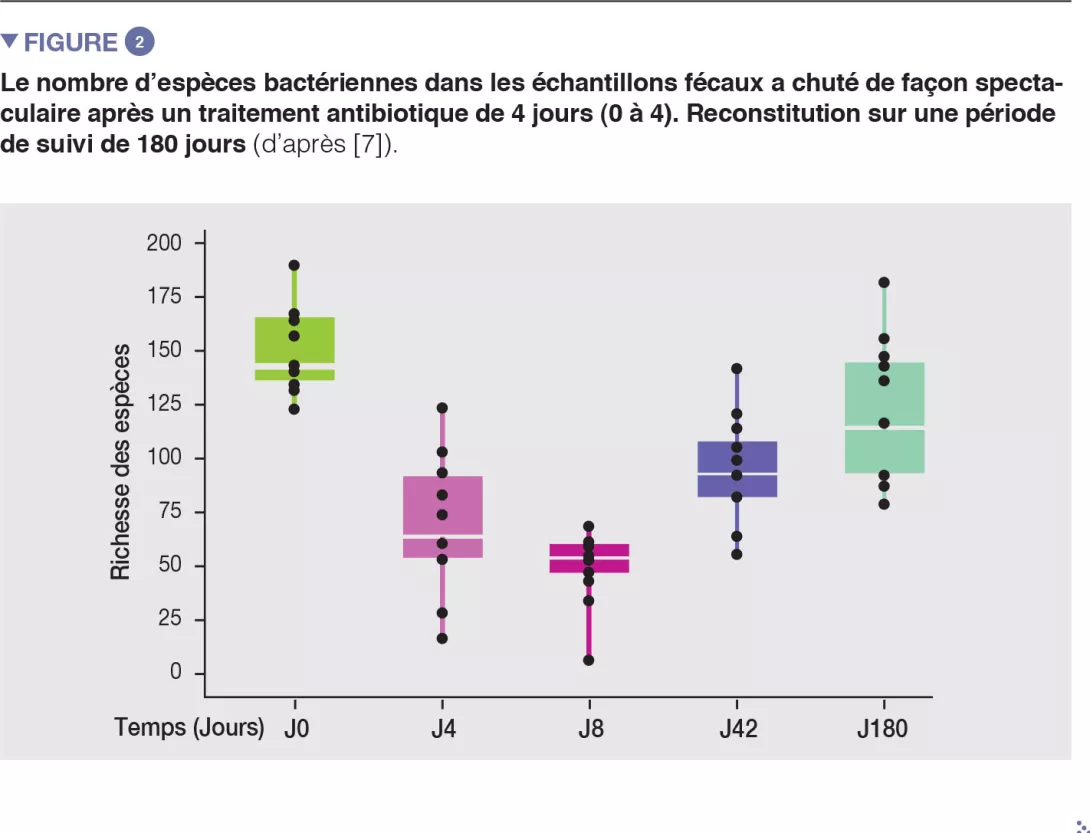
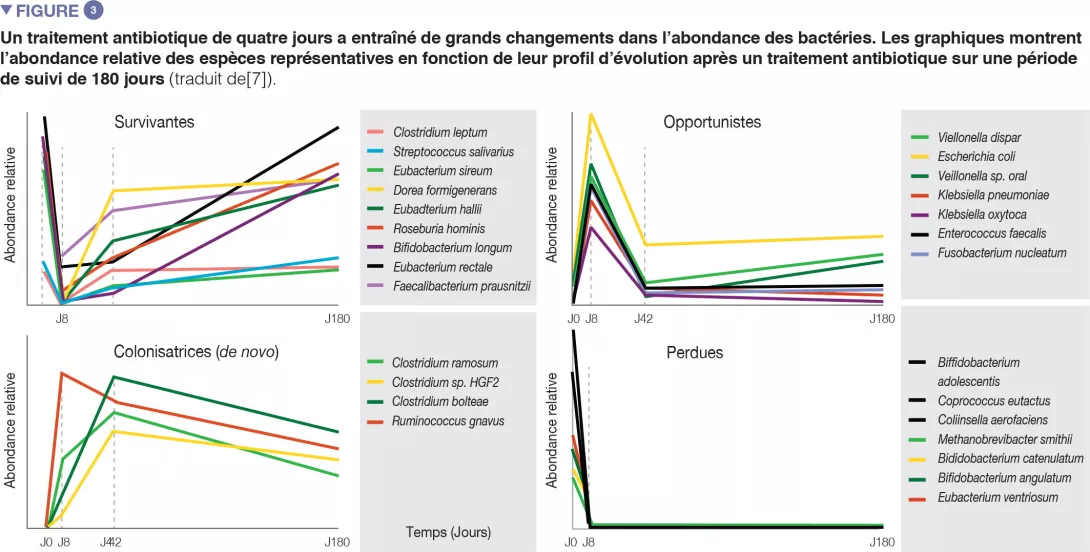
Chez des volontaires sains, une intervention antibiotique de 4 jours a entraîné la prolifération d’entérobactéries et d’autres pathobiontes, comme Enterococcus faecalis et Fusobacterium nucleatum, et la déplétion des bactéries du genre Bifidobacterium et des producteurs de butyrate [7]. Le microbiote intestinal des sujets étudiés est revenu à un état proche de l’état initial en 1,5 mois, bien que 9 espèces, qui étaient présentes chez tous les sujets avant le traitement, soient restées indétectables après 180 jours (Figures 2 et 3).
La dysbiose correspond à une altération de la composition et de la fonction du microbiote, qui entraîne des perturbations de l’écosystème microbien dépassant ses capacités de résistance et de résilience [8]. L’impact fonctionnel des antibiotiques sur les producteurs d’acides gras à chaîne courte, et en particulier de butyrate, pourrait avoir des conséquences à long terme en raison de la rupture de l’équilibre symbiotique entre le microbiote et l’hôte. L’incapacité à produire du butyrate augmente le flux d’oxygène en direction de la muqueuse et perturbe le micro-écosystème en favorisant la survie des bactéries résistantes à l’oxygène (entérobactéries) et en empêchant la récupération des producteurs de butyrate comme Faecalibacterium, qui sont des anaérobies stricts [9]. Ces modifications affectent gravement la capacité de résilience de l’écosystème et font évoluer le déséquilibre vers la chronicité.
Les effets indésirables des antibiotiques sur le microbiote intestinal et la perte d’attributs fonctionnels qui s’ensuit pourraient entraîner la rupture de l’équilibre symbiotique entre le microbiote et l’hôte.
Le résistome
Le résistome est l’ensemble des gènes bactériens qui contribuent directement ou indirectement à la résistance aux antibiotiques. Les gènes de résistance ne semblent pas avoir été sélectionnés en réponse à une exposition récente aux antibiotiques. Ces derniers, de même que la résistance, existent depuis des centaines de millions d’années, et le nombre de gènes composant le résistome reflète la co-évolution continue des micro-organismes producteurs d’antibiotiques et des micro-organismes cibles. La composition du résistome et la prévalence des gènes de résistance dans les bactéries associées à l’homme s’adaptent aux forces sélectives dérivées de l’action humaine.
Les espèces porteuses de gènes de résistance aux β-lactamines sont sélectionnées positivement pendant et après l’administration d’antibiotiques [7]. De même, le portage de gènes de résistance aux aminoglycosides augmente les probabilités de colonisation de novo. Le portage de gènes de résistance aux antibiotiques module le processus de récupération après l’administration d’antibiotiques [7].
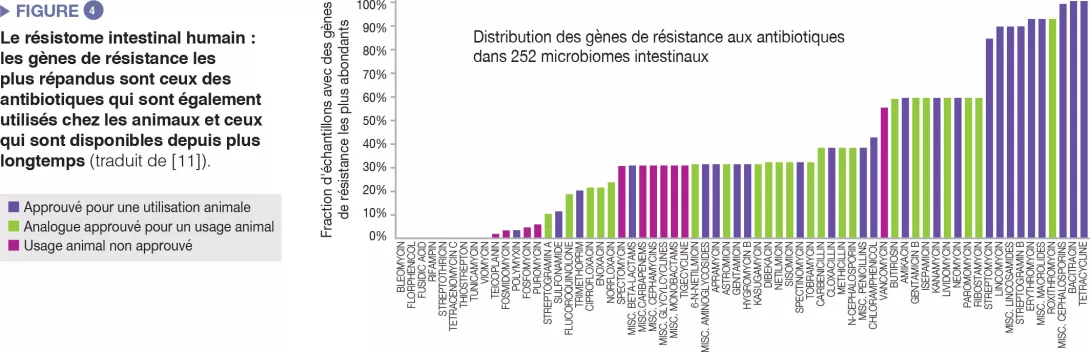
Le microbiome intestinal humain héberge un répertoire divers de gènes de résistance aux antibiotiques, que l’on peut analyser grâce à des technologies de séquençage moléculaire [10]. Une étude portant sur 252 échantillons fécaux humains provenant de différents pays a montré que les gènes de résistance les plus abondants dans le microbiome sont ceux correspondant aux antibiotiques également utilisés chez l’animal et à ceux disponibles depuis longtemps (Figure 4) [11]. Une correspondance a été établie entre les données sur le recours aux antibiotiques chez l’homme et l’animal, et les différences spécifiques à chaque pays ont été observées au niveau de la prévalence des gènes de résistance. Dans l’ensemble, ces données suggèrent l’existence d’une corrélation positive entre l’exposition aux antibiotiques et la prévalence des gènes d’antibiorésistance.
Certains gènes de résistance s’échangent facilement entre les bactéries par transfert horizontal. Des études ont montré qu’en cas de stress induit par les antibiotiques, des bactéries opportunistes disséminent les gènes de résistance au sein de la communauté microbienne. Une étude longitudinale du microbiome intestinal conduite chez des enfants finlandais a montré que le recours aux antibiotiques favorisait la dispersion des gènes d’antibiorésistance dans l’intestin en raison de la prolifération de bactéries porteuses de gènes de résistance et de la mobilisation accrue de ces gènes par les plasmides [12]. Les gènes de résistance aux antibiotiques présents sur les chromosomes microbiens ont montré un pic d’abondance après l’antibiothérapie, puis une forte baisse, alors que l’abondance des gènes de résistance présents sur les éléments mobiles persistait longtemps après la fin de l’antibiothérapie. Ce phénomène pourrait s’expliquer par le fait que les gènes épisomiques peuvent se diffuser largement entre différentes espèces par transfert horizontal.
En conditions de stress induit par les antibiotiques, des bactéries opportunistes disséminent les gènes de résistance au sein de la communauté microbienne intestinale. Le microbiote intestinal humain est un réservoir de gènes de résistance pour les micro-organismes pathogènes.
Le microbiote intestinal humain pourrait constituer le réservoir de gènes de résistance le plus accessible pour les microorganismes pathogènes. Un traitement antibiotique précoce est associé à une réduction de la diversité microbienne, mais également à un risque accru d’antibiorésistance.
Les probiotiques pourraient prévenir la prolifération d’espèces résistantes pendant l’antibiothérapie et minimiser l’expansion des gènes de résistance aux antibiotiques.
Antibiotiques et risque de maladies
Des perturbations de l’écosystème microbien intestinal dans les premières années de vie et un terrain génétique favorable pourraient avoir un impact à long terme sur le système immunitaire, ce qui se traduit plus tard par des maladies ou une prédisposition aux maladies. Il a en effet été démontré que les maladies inflammatoires chroniques de l’intestin, les maladies métaboliques (diabète de type 2, obésité) et les maladies atopiques étaient associées à une altération de la composition du microbiote intestinal.
Le fait qu’une exposition répétée aux antibiotiques déclenche des altérations du microbiote intestinal ainsi qu’une inflammation est une hypothèse fréquemment avancée pour expliquer la pathogenèse des troubles inflammatoires. Une étude a montré que les nourrissons recevant des antibiotiques avant l’âge d’un an avaient 5,5 fois plus de risque de développer une MICI que les enfants non exposés [13]. De la même manière, une exposition aux antibiotiques au cours des deux premières années de vie, période de développement des populations adipocytaires de l’hôte, est associée à une obésité infantile [14]. La réduction de la richesse microbienne intestinale a été associée à une augmentation de l’adiposité, à une résistance à l’insuline et à la leptine, et à un phénotype inflammatoire plus prononcé.
Conclusion
Malgré la capacité de résilience du microbiote intestinal, la dispersion des gènes d’antibiorésistance constitue aujourd’hui une menace majeure pour la santé humaine, et l’utilisation excessive des antibiotiques semble en être la cause principale. En outre, de plus en plus d’éléments établissent un lien entre la fragilité du microbiote humain dans les pays industrialisés et l’expansion des maladies chroniques non transmissibles [3]. Là encore, l’exposition aux antibiotiques est une cause évidente. L’adoption de pratiques médicales plus durables constitue un défi majeur de santé publique au XXIe siècle. Une utilisation restreinte et rationnelle des antibiotiques représente incontestablement la meilleure manière de prévenir les déséquilibres néfastes du microbiote intestinal humain. Par ailleurs, l’utilisation d’un probiotique à l’efficacité prouvée pour la prévention des diarrhées induites par les antibiotiques a permis de limiter la prolifération d’espèces résistantes pendant l’antibiothérapie [15]. Cette stratégie pourrait également réduire la dispersion des gènes de résistance aux antibiotiques.
Depuis 2015, l'OMS organise chaque année la Semaine mondiale de sensibilisation à la résistance aux antimicrobiens (WAAW) dont l'objectif est de sensibiliser sur le phénomène mondial de la résistance aux antimicrobiens. Cette campagne, qui se tiendra du 18 au 24 novembre, encourage le grand public, les professionnels de santé et les décideurs à faire un bon usage des antimicrobiens afin d'éviter l'apparition de résistance.