¿Es importante el impacto de los antibióticos en la microbiota intestinal?
Síntesis
Por el Pr. Francisco Guarner
Servicio de Aparato Digestivo, Hospital Vall d’Hebron, Barcelona, España.
Espacio para el público general
Encuentra aquí tu espacio dedicado
en_sources_title
en_sources_text_start en_sources_text_end
Capítulos

Acerca de este artículo
Autor
El uso extensivo e inadecuado de antibióticos puede conducir no solo a infecciones resistentes a los antimicrobianos, sino también a incrementar la incidencia de enfermedades crónicas no transmisibles. El consumo de antibióticos y las vacunas han contribuido más a aumentar la esperanza de vida que cualquier otra innovación médica. Los antibióticos se encuentran entre los hitos médicos más reconocidos, según los expertos consultados por el British Medical Journal [1]. Tras la introducción de medidas de prevención y tratamiento de enfermedades infecciosas, los cambios han sido gigantescos. Las infecciones solían ser la causa del 30 % de las muertes, especialmente de niños menores de 5 años, pero a finales del siglo XX, menos del 4 % de las muertes se debían a una infección [1]. Sin embargo, recientemente han surgido dos importantes motivos de preocupación. En primer lugar, los tratamientos de un número creciente de infecciones son menos efectivos debido a resistencias. La resistencia a los antibióticos supone en la actualidad una seria amenaza a la salud humana, y su vínculo con el consumo excesivo de antibióticos está bien documentado [2]. En segundo lugar, los antibióticos destinados a eliminar microbios patógenos han tenido consecuencias imprevistas para el ecosistema microbiano humano, con cambios que pueden ser difíciles de revertir [3]. El cuerpo humano acoge un complejo conjunto de microbios conocido como microbioma o microbiota, que desempeñan importantes funciones para la salud. La alteración de la microbiota y la consiguiente pérdida de atributos funcionales pueden provocar que las comunidades microbianas de personas que viven en sociedades industrializadas sean poco eficaces para su salud [3]. Estos asuntos requieren una sensibilización del colectivo médico y pautas claras por parte de las autoridades responsables de las políticas de salud.
Impacto del consumo ingente de antibióticos
Según el informe de la OMS de 2018 [2], la cantidad total de antibióticos consumida por los humanos se encuentra muy por encima de las 6500 toneladas anuales (datos de 65 países, China y EE. UU. no están incluidos). Una media de 18 de cada 1000 habitantes consume diariamente una dosis definida de antibióticos, lo que significa que cada día del año se consumen 139 millones de dosis. La media es menor en los países africanos (12 de cada 1000) que en Europa (17,8) o América (18,2), mientras que las infecciones causan hasta el 36,6 % del total de las muertes en África, pero solo el 2,7 % o el 4,5 % en Europa o América. Los países de renta baja siguen teniendo elevadas tasas de mortalidad debido a enfermedades infecciosas, pero tasas bajas de consumo de antibióticos. El acceso limitado, el uso de fármacos no adecuados o de pautas de tratamiento erróneas, puede contribuir a la aparición de infecciones resistentes en países de renta baja, como la tuberculosis.
En los países desarrollados, hasta la mitad de las recetas de antibióticos pueden considerarse inadecuadas [2]. El consumo innecesario de antibióticos acelera el desarrollo de resistencias, y las cepas multirresistentes de Pseudomonas aeruginosa, Escherichia coli, Klebsiella pneumoniae, Staphylococcus aureus, están aumentando [2].
Aclamados como uno de los principales adelantos de la medicina en el siglo XX, los antibióticos han salvado millones de vidas. Sin embargo, también afectan a nuestra microbiota y provocan disbiosis. Examinemos de más cerca este papel ambivalente.
El papel ambivalente de los antibióticos
Disbiosis provocada por antibióticos
Aunque la mayoría de tratamientos con antibióticos no producen efectos secundarios inmediatos y evidentes, existe la preocupación de que los daños colaterales alteren la composición de la microbiota intestinal y sus funciones [3]. La diarrea postantibiótica es la complicación más comúnmente reconocida causada por antibióticos, y se presenta entre el 15 y el 25 % de los pacientes. La mayoría de los episodios de diarrea causada por antibióticos son leves y remiten espontáneamente. Sin embargo, en un creciente número de casos aparecen formas más severas, como la diarrea causada por Clostridioides difficile. Los trastornos relacionados con los antibióticos promueven la germinación de esporas de C. difficile en el intestino, la hiperproliferación de formas vegetantes y la producción de toxinas que derivan en daño epitelial y colitis. La presentación clínica es variable desde diarrea benigna autolimitada o recurrente, a megacolon tóxico, colitis fulminante y muerte [4].
Desde el nacimiento, la microbiota intestinal humana aumenta rápidamente su diversidad durante los tres primeros años de vida, antes de estabilizarse en el estado adulto. A partir de ahí, el núcleo de especies dominantes es estable pero la abundancia de las distintas bacterias puede fluctuar como respuesta a factores externos (alimentación, medicamentos, viajes, etc.). Los estudios han mostrado que los efectos de los antibióticos dan lugar a variaciones muy grandes en abundancias relativas. En pacientes tratados con betalactámicos o quinolonas, el núcleo de la microbiota se redujo de 29 a 12 taxones, el número total de taxones observados disminuyó en un 25 % y se produjo un cambio de Faecalibacterium a Bacteroides como género dominante [5].
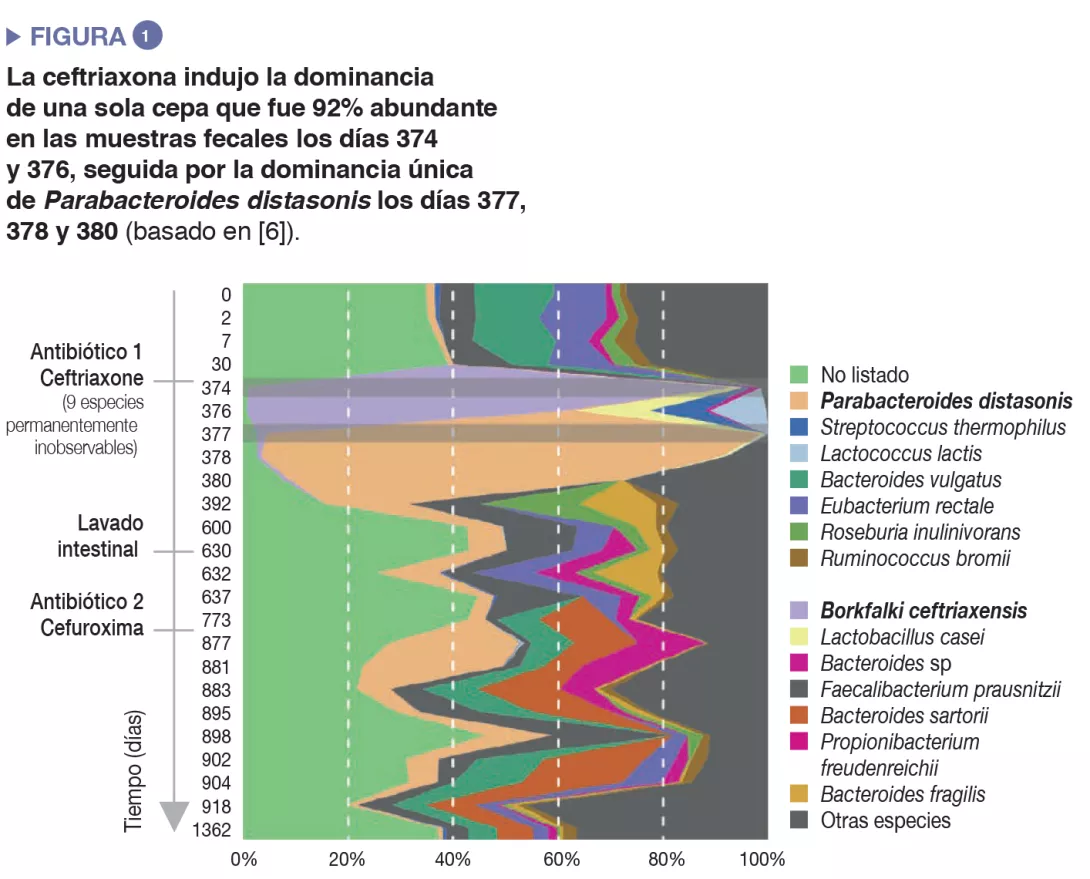
El uso de antibióticos indujo una disminución de la diversidad microbiana (pérdida de la riqueza del ecosistema) y una hiperproliferación de especies resistentes, que produjo un aumento general de la carga microbiana, es decir, del número de bacterias por gramo de heces [5]. Se han notificado casos extremos de proliferación causada por antibióticos con monodominancia de una sola cepa que alcanzaba el 92 % de abundancia relativa en muestras fecales después del tratamiento con ceftriaxona intravenosa [6]. (Figura 1).
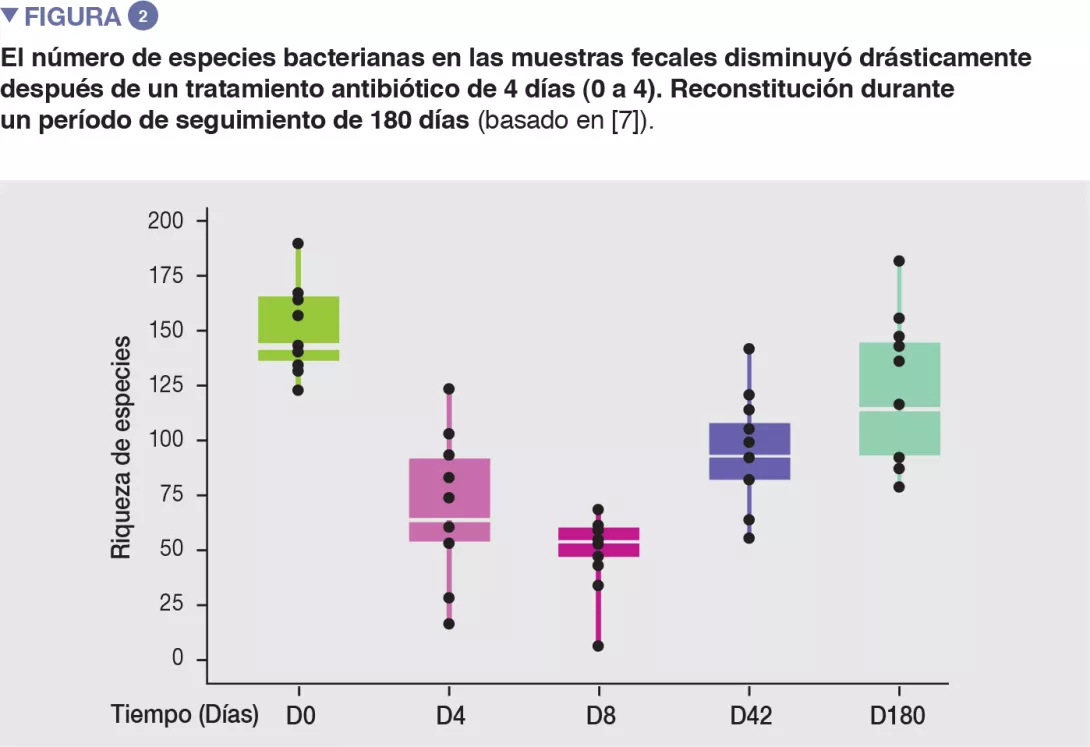
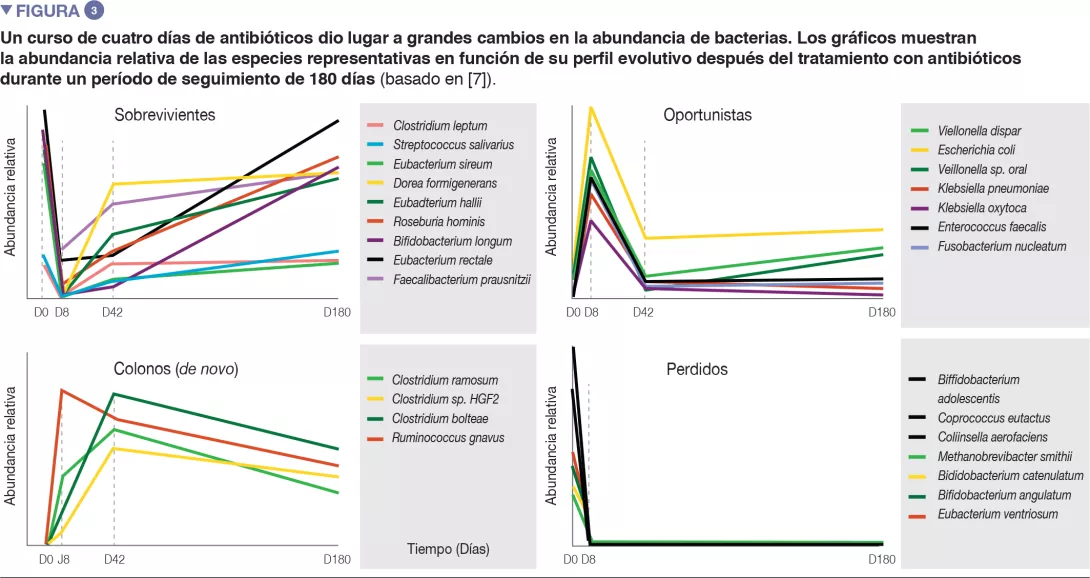
En voluntarios sanos, una intervención de cuatro días con antibióticos condujo a sobrecrecimiento de enterobacterias y otros microbios patógenos (Enterococcus faecalis, Fusobacterium nucleatum), y a la reducción de especies de Bifidobacterium y de productoras de butirato [7]. La microbiota intestinal tardó 6 semanas en recuperar una composición similar a la inicial, aunque 9 especies comunes que estaban presentes en todos los pacientes antes del tratamiento se mantuvieron indetectables tras 180 días. (Figuras 2 y 3).
La disbiosis es una alteración de la composición y las funciones de la microbiota que perturba el ecosistema microbiano hasta el punto de superar sus capacidades de resistencia y resiliencia [8]. El impacto funcional de los antibióticos en los productores de ácidos grasos de cadena corta, y de butirato en particular, puede tener consecuencias a largo plazo, ya que origina una ruptura del equilibrio simbiótico entre microbiota y anfitrión. La incapacidad de producir butirato aumenta el flujo de oxígeno hacia la mucosa y perturba el microecosistema de manera que favorece la supervivencia de bacterias resistentes al oxígeno (enterobacterias) e impide la recuperación de productoras de butirato como Faecalibacterium, que son anaerobias estrictas [9]. Esos cambios afectan críticamente a la capacidad de resiliencia del ecosistema y perpetúan el desequilibrio hacia la cronicidad.
Los efectos secundarios no deseados de los antibióticos en la microbiota intestinal y la consiguiente pérdida funcional puede alterar el equilibrio simbiótico entre microbiota y anfitrión.
El resistoma
El resistoma es la agrupación de todos los genes bacterianos que contribuyen directa o indirectamente a la resistencia a los antibióticos. Los genes de resistencia no parecen haber sido seleccionados como respuesta a la reciente exposición a antibióticos. Los antibióticos se remontan a cientos de millones de años, al igual que la resistencia, y la cantidad de genes del resistoma es el reflejo de la coevolución continua de organismos productores de antibióticos y sus destinatarios. La composición del resistoma y la prevalencia de genes de resistencia en bacterias vinculadas a los seres humanos se adaptan a las fuerzas selectivas derivadas de la acción humana.
Se ha demostrado que las especies que albergan genes de resistencia a los betalactámicos se seleccionan durante y después del consumo de este tipo de antibióticos [7]. Del mismo modo, albergar genes de resistencia a los aminoglicósidos aumenta las posibilidades de colonización de novo durante el tratamiento antibiótico. Ser portador de genes de resistencia a los antibióticos modula el proceso de recuperación tras el consumo de antibióticos [7].
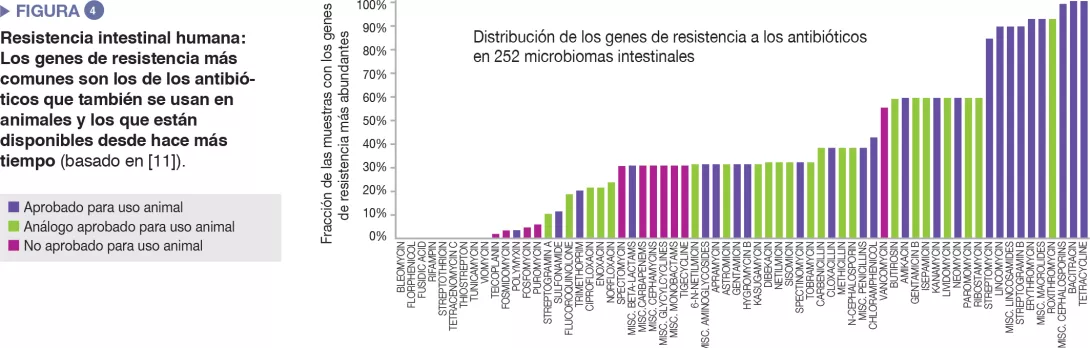
El microbioma intestinal humano acoge un diverso repertorio de genes de resistencia a los antibióticos, que puede investigarse mediante tecnologías de secuenciación molecular [10]. Un estudio realizado en 252 muestras fecales humanas de diferentes países descubrió que los genes de resistencia más prevalentes en el microbioma corresponden a antibióticos que también se usan en animales y a antibióticos disponibles en el mercado desde hace mucho tiempo [11]. Los datos de los países sobre el uso de antibióticos en humanos y animales coincidían con las diferencias observadas en la prevalencia de genes de resistencia en cada país. En conjunto, los datos sugieren una correlación positiva entre la exposición a antibióticos y la prevalencia de genes de resistencia a antibióticos..
Algunos genes de resistencia a antibióticos se intercambian fácilmente entre bacterias mediante la transferencia horizontal de genes. Los estudios han demostrado que, bajo el estrés provocado por los antibióticos, las bacterias oportunistas propagan los genes de resistencia en la comunidad microbiana. En un estudio longitudinal del microbioma intestinal en niños finlandeses se observó que el consumo de antibióticos promovía la expansión de los genes en el intestino, debido a la proliferación de bacterias que albergan genes de resistencia y a la mayor movilización de genes de resistencia por plásmidos [12]. Los genes de resistencia a antibióticos integrados en el cromosoma mostraban un pico de abundancia tras el tratamiento con antibióticos seguido de un brusco descenso, mientras que la abundancia de genes de resistencia transportados en elementos móviles persistió mucho tiempo después de que finalizara la terapia antibiótica. Esto se explica por el hecho de que los genes episómicos pueden propagarse ampliamente a múltiples especies mediante transferencia horizontal de genes.
Bajo el estrés provocado por los antibióticos, las bacterias oportunistas propagan genes de resistencia a la comunidad microbiana intestinal. La microbiota intestinal humana es un reservorio de genes de resistencia en el que los patógenos pueden adquirir resistencias.
Es posible que la micr humana sea el reservori de genes de resistencia El tratamiento antibiótico etapas de la vida se asoc sidad microbiana reduci con un mayor riesgo de d tencia a los antibióticos.
Los probióticos pueden prevenir la proliferación de especies resistentes durante el tratamiento antibiótico y minimizar la propagación de genes de resistencia a antibióticos.
Antibióticos y riesgo de enfermedad
Las perturbaciones del ecosistema microbiano intestinal durante las primeras etapas de la vida, combinadas con una susceptibilidad genética, pueden tener un impacto duradero en el sistema inmunitario que conduzca a enfermedad o a predisposición a enfermedad en el futuro. De hecho, se ha demostrado que las enfermedades intestinales inflamatorias, los trastornos metabólicos (diabetes de tipo 2, obesidad) y las enfermedades atópicas están asociadas a una composición alterada de la microbiota intestinal.
La principal hipótesis relacionada con la patogénesis de los trastornos inflamatorios es que las alteraciones de la microbiota intestinal causadas por la exposición repetida a los antibióticos desencadena la inflamación. Se observó que los lactantes que reciben antibióticos antes del año de edad tienen un riesgo 5,5 veces mayor de padecer una EII que los no expuestos [13]. Asimismo, la exposición a los antibióticos en los dos primeros años de vida, cuando se desarrollan las poblaciones de adipocitos en el anfitrión, se relaciona con el diagnóstico de obesidad infantil [14]. La riqueza microbiana intestinal reducida se asocia con aumento de adiposidad, resistencia a la insulina y a la leptina, y fenotipo inflamatorio más pronunciado.
Conclusión
A pesar de la resistencia de la microbiota intestinal, la propagación de genes de resistencia a los antibióticos actualmente supone una seria amenaza para la salud humana, y el consumo excesivo de antibióticos parece ser la causa principal. Además, hay una creciente evidencia que vincula la fragilidad de la microbiota humana en países industrializados con el incremento coincidente de enfermedades crónicas notransmisibles [3]. De nuevo, la exposición a los antibióticos es una causa evidente de este trastorno de la microbiota. El cambio de las tendencias actuales hacia prácticas médicas más sostenibles es uno de los grandes retos de la salud pública del siglo XXI. Sin duda, un uso restringido y racional de los antibióticos es la mejor manera y la más eficaz de prevenir desequilibrios perjudiciales para el microbioma intestinal humano. Cabe destacar que el uso de un probiótico con eficacia comprobada para prevenir la diarrea postantibiótica limita la proliferación de especies resistentes durante el tratamiento con antibióticos [15]. Potencialmente, esta estrategia también podría minimizar la propagación de genes de resistencia a los antibióticos.
Desde 2015, la OMS organiza cada año la Semana mundial de concienciación sobre la RAM (WAAW), cuyo objetivo es sensibilizar al público sobre la resistencia mundial a los antimicrobianos. Esta campaña, que tendrá lugar del 18 al 24 de noviembre, alienta al público general, a los profesionales sanitarios y a los responsables a hacer un uso razonable de los antimicrobianos para evitar el desarrollo de resistencia a los antimicrobianos.