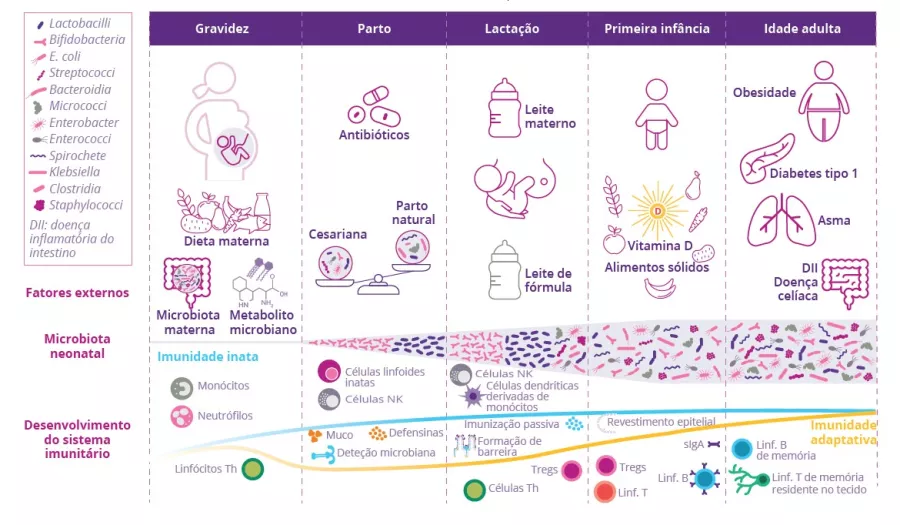
Fatores que influenciam o desenvolvimento da microbiotae a maturação do sistema imunitario no inicio da vida
O nascimento representa a maior mudança ambiental substancial da vida, uma vez que o recém-nascido é exposto pela primeira vez a uma variedade incontável de micróbios que colonizam todas as superfícies do corpo, levando ao estabelecimento da microbiota comensal em paralelo com o sistema imunitário. Múltiplos fatores moldam a composição da microbiota intestinal e a maturação do sistema imunitário do recém-nascido (figura 3). As anomalias na interação entre a microbiota e a imunidade durante cada estágio de desenvolvimento podem ter efeitos de longo prazo na suscetibilidade a doenças.13
Área para o público geral
Encontre aqui o seu espaço dedicado
en_sources_title
en_sources_text_start en_sources_text_end
Capítulos

Sobre este artigo
Autores
O nascimento tem impacto na composição da microbiota intestinal...
Dr Travis J. De Wolfe
O tipo de parto determina os tipos de bactérias da mãe que são transmitidas ao intestino neonatal.14 Os bebés nascidos através do canal de parto trazem normalmente muitas bactérias intestinais que sintetizam lipopolissacarídeo (LPS), um importante componente da membrana das bactérias Gram-negativas que podem preparar adequadamente o sistema imunitário humano para responder de forma apropriada às ameaças microbianas.15 Em contrapartida, as crianças nascidas por cesariana estão predispostas a serem colonizadas por agentes patogénicos oportunistas em circulação nos hospitais.14
...Bem como na maturação da estrutura imunitária
Estas diferenças na colonização microbiana inicial podem afetar a maturação subsequente das estruturas linfoides inatas locais e alterar a população de células T reguladoras (Treg) protetoras, implicando efeitos a longo prazo na fisiologia intestinal humana. A maturação das células T e a indução de fatores imunitários podem proteger contra, ou, em alguns casos, contribuir para, doenças autoimunomediadas (diabetes, esclerose múltipla, etc.) que surgem mais tarde na vida.15,16
Impacto dos antibióticos nas respostas imunitárias
Dr Pascal Lavoie
Os antibióticos são essenciais para tratar infeções bacterianas graves; no entanto, a exposição desnecessária a antibióticos pode ter consequências graves para a saúde e deve ser evitada (nomeadamente quando a infeção for causada por um vírus). Em adultos mais idosos, o uso prolongado de antibióticos pode levar a uma proliferação excessiva de um agente patogénico bacteriano intestinal denominado Clostridioides difficile, com consequências potencialmente fatais.17 A utilização excessiva de antibióticos pode também provocar resistência antimicrobiana, o que eventualmente limitará as opções de tratamento de infeções futuras.18 Em modelos animais, a perturbação da microbiota intestinal causada pelos antibióticos altera as funções imunitárias e os limiares da resposta imunitária.19 Dados em seres humanos indicam que o recurso desnecessário a antibióticos pode aumentar o risco de surgimento de problemas de saúde crónicos, como diabetes tipo I, asma, alergias ou até obesidade.20 Sabe-se ainda que o uso prolongado de antibióticos (> 1 semana) reduz a diversidade da microbiota intestinal, sendo os bebés nascidos prematuramente os mais vulneráveis a esse tipo de perturbações. O uso prolongado de antibióticos de largo espectro na mãe ou no bebé prematuro reduz a diversidade bacteriana intestinal, aumentando o risco de sépsis e de enterocolite necrosante.21 Em geral, os dados em humanos confirmam o conceito segundo o qual a microbiota intestinal desempenha um papel importante, ajudando os bebés a tornarem-se adultos saudáveis. Embora os riscos da exposição excessiva a antibióticos sejam menos graves nos adultos, ela pode continuar a afetar o desenvolvimento das suas respostas imunitárias, pelo que o recurso a antibióticos em qualquer idade deve limitar-se aos casos em que estes sejam estritamente necessários.
A disbiose não é universal e define-se para cada indivíduo em função do seu estado de saúde. Uma definição habitual descreve-a como uma alteração funcional e da composição da microbiota que é gerada por um conjunto de fatores ambientais e relacionados com o hospedeiro que perturbam o ecossistema microbiano.9
FIGURA 3: Fatores ambientais que influenciam o desenvolvimento da microbiota e do sistema imunitário da mucosa dos recém-nascidos.
Adaptado de Kalbermatter C et al, 202113
Ao longo da gravidez, os metabolitos microbianos (oriundos da dieta e da microbiota maternas) influenciam o desenvolvimento imunitário fetal. Desde o nascimento, a colonização da microbiota começa em paralelo com o desenvolvimento do sistema imunitário. Nesta fase, o recém-nascido depende ainda da proteção materna que lhe é assegurada pela amamentação: o leite materno contém antigénios bacterianos originários da mãe que estimulam a maturação do sistema imunitário inato da mucosa. Relativamente à colonização da microbiota intestinal, as famílias bacterianas Enterococcacae, Clostridiaceae, Lactobacillaceae, Bifidobacteriaceae e Streptococcaceae são dominantes nas primeiras semanas de vida. A introdução dos alimentos sólidos na dieta da criança leva a um aumento da diversidade da microbiota intestinal, que evolui para uma microbiota mais adulta: a abundância em Bifidobacteriaceae diminui, enquanto Bacteroides, Ruminococcus e Clostridium se tornam mais predominantes. O tipo de parto, o leite materno, os alimentos sólidos e a ingestão de antibióticos são fatores que moldam a microbiota e o sistema imunitário neonatal.
Prova de conceito: a colonização da microbiota intestinal é essencial ao desenvolvimento do sistema imunitário
Dr Travis J. De Wolfe
Estudos com ratos axénicos (livres de germes) demonstraram o importante papel que a microbiota desempenha na prevenção de um sistema imunitário imperfeito.22 É inibida a produção de células CD4 - linfócitos T auxiliares positivos nos ratinhos para, enquanto se realiza a colonização seletiva dos mesmos com Clostridia, um grupo bacteriano comensal, poder induzir-se a produção dessas células que, subsequentemente, favorecem o aumento das defesas antimicrobianas no intestino e protegem contra a infeção por agentes patogénicos.23 Os anticorpos IgA são outro elemento fundamental do sistema imunitário em falta nos ratos axénicos. Estes anticorpos ligam-se às bactérias comensais e impedem que se escapem do trato gastrointestinal. A colonização seletiva de ratos livres de germes com uma estirpe de Escherichia coli ou diferentes cepas de Bacteroides desencadeia uma rápida recuperação/normalização dos IgA.24,25