Destaques do 55º ESPGHAN
Pela Dra. Tania Mahler
Médico, Gastroenterologia Pediátrica e Nutrição, Clínico adjunto no Hospital Universitário Infantil Rainha Fabíola, Bélgica
Área para o público geral
Encontre aqui o seu espaço dedicado
en_sources_title
en_sources_text_start en_sources_text_end
Capítulos

Sobre este artigo
Na reunião ESPGHAN (Sociedade Europeia de Gastroenterologia, Hepatologia e Nutrição Pediátrica) 2023, realizada em Viena, reuniram-se 4300 participantes de todo o mundo. Após o período desafiante da pandemia de Covid-19, este evento proporcionou uma experiência revitalizante, uma vez que os participantes puderam participar em apresentações ao vivo e ter discussões presenciais. Esta interação presencial provou ser significativamente mais agradável e enriquecedora do que as alternativas virtuais. Vários grupos de investigação centraram o seu trabalho no microbioma intestinal e apresentaram dados convincentes no domínio da pediatria.
O impacto do microbioma na saúde e na doença é amplamente reconhecido, pelo que é evidente que também os clínicos e investigadores pediátricos tentam compreender melhor como podemos manipular o microbioma e como, utilizando a assinatura do microbioma, podemos detetar a doença numa fase precoce. Esta revisão tem como objetivo lançar luz sobre vários tópicos-chave que têm sido amplamente discutidos
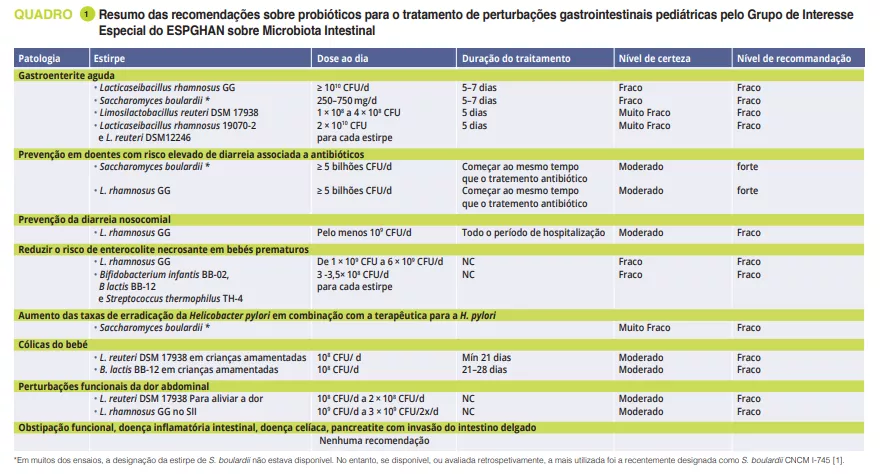
Recomendações para a utilização de probióticos em doenças gastrointestinais pediátricas selecionadas
Em fevereiro de 2023, o grupo de interesse especial da ESPGHAN sobre a microbiota intestinal publicou recomendações para a utilização de probióticos na gestão de perturbações gastrointestinais pediátricas selecionadas, com base em revisões sistemáticas e/ou meta-análises utilizando o processo Delphi- modificado [1]. Na reunião do grupo de interesse especial sobre microbiota intestinal e modificações, o Prof. Szajewska mostrou-nos os resultados deste trabalho. Apenas algumas estirpes probióticas específicas demonstram alguma utilidade em determinadas condições. No artigo original1 pode encontrar uma visão geral clara das recomendações atuais.
Transplante de microbiota fecal (FMT) em adolescentes que sofrem de síndrome do intestino irritável (SII) refratária
A Dra. De Bruijn, do grupo do UMC de Amesterdão, apresentou na sessão plenária do resumo com maior pontuação o seu estudo sobre a eficácia do FMT em adolescentes com SII refratária, num ensaio aleatório, em dupla ocultação e controlado por placebo [2]. A sua intervenção foi fascinante, mas também suscitou muitas reações na audiência quando mostrou um diapositivo de um doente a receber seringas com material fecal. Tanto quanto sabemos, apenas um outro estudo pediátrico avaliou o FMT para aliviar o inchaço abdominal, outra caraterística dos distúrbios da interação intestino-cérebro e que está frequentemente presente na SII [3].
A dor crónica na SII pode ter um enorme impacto no funcionamento de crianças e adultos, levando ao absentismo na escola e no trabalho e a uma má qualidade de vida. A origem da doença é multifatorial e pode ser melhor explicada pelo modelo biopsicossocial. Um dos principais fatores é a disbiose da microbiota intestinal. Em adultos, foram publicados diferentes estudos sobre o efeito positivo observado com o FMT [4].
Em pediatria, os tratamentos não farmacológicos como a educação, a hipnose e a atenção plena são mais eficazes do que a terapia farmacológica [5]. No entanto, em cerca de 25% dos doentes, os sintomas persistem. Os pré, pró e simbióticos são testados com vários resultados para corrigir a disbiose na SII. A mudança para uma dieta FODMAP também pode influenciar a flora gastrointestinal [5]. Mas em grupos específicos de pacientes, o FMT pode ser, se for segura, o tratamento definitivo para restaurar efetivamente um microbioma gastrointestinal saudável. No estudo de De Bruijn et al., 32 pacientes com SII refratária entre 16 e 21 anos de idade foram recrutados e randomizados. Um grupo recebeu infusões fecais alogénicas (de um dador saudável) e o outro grupo recebeu infusões fecais autólogas (do próprio) por sonda nasogástrica no início e 6 semanas depois. A eficácia clínica foi definida como a proporção de doentes com uma redução de mais de 50 pontos no IBS Severity-Scoring-System (IBS-SSS). Os pacientes foram avaliados 12 semanas e 6 meses após o TMF. Ambos os grupos tinham um IBS-SSS semelhante no início do tratamento. Após a primeira avaliação não houve diferença estatística, mas aos 6 meses de seguimento houve uma melhoria em 60% dos pacientes que receberam TMF alogénico versus 25% no grupo autólogo (p = 0,048). O resultado secundário incluiu a qualidade de vida relacionada com a saúde (QdV). A pontuação total da QdV na linha de base não diferiu entre os grupos, mas melhorou significativamente após o TMF alogénico. Não foram registados quaisquer eventos adversos. O TMF alogénico parece ser uma forma interessante de tratar a SII refratária em jovens, mas são necessários mais estudos.
Microbiota e doenças inflamatórias intestinais (IBD)
Na sessão de gastroenterologia sobre DII, um grupo checo apresentou um estudo que tinha como objetivo avaliar se as alterações na microbiota na DC se deviam ao tratamento anti-TNFα ou se eram o resultado de uma diminuição da atividade inflamatória da mucosa [6]? Assim, compararam crianças em tratamento anti-TNFα com doença de Crohn (DC) ativa e artrite idiopática juvenil (AIJ). Os seus resultados mostraram que a cicatrização da mucosa na DC era essencial para obter alterações no bacterioma. O tratamento anti-TNFα na AIJ não teve qualquer impacto no bacterioma deste grupo de doentes. Schwerd et al. acompanharam 20 pacientes pediátricos recém-diagnosticados com DC tratados primeiramente com nutrição enteral exclusiva (NEE) com amostragem de fezes [7]. Quinze dos vinte pacientes entraram em remissão. Eles demonstraram claras mudanças temporais e individuais no microbioma intestinal e nos metabólitos com abundância reduzida de Lachnospiraceae e enriquecimento de ácidos graxos insaturados de cadeia longa. A fermentação ex vivo com um meio semelhante ao EEN e a subsequente transferência em modelos de ratos gnotobióticos mostrou um efeito protetor em contraste com os meios ricos em fibras e com os colonizados diretamente com a microbiota de base do doente. Com base nestes resultados, concluíram que os microbiomas dos doentes modulados por EEN estão a regular a inflamação intestinal. Também se debruçaram sobre a possibilidade de utilizar uma dieta pobre em fibras para uma remissão a longo prazo. Um estudo multicêntrico realizado no Reino Unido (crianças e adultos) estudou a possibilidade de utilizar uma dieta de alimentos sólidos para a Doença de Crohn TReatment-with-EATing (CD-TREAT) para criar uma dieta mais palatável que poderia influenciar a inflamação intestinal através da alteração das bactérias intestinais [8]. A dieta é personalizada para cada doente, mas exclui componentes alimentares específicos como o glúten, a lactose e o álcool. Os 55% dos doentes que aderiram a este regime apresentaram uma calprotectina fecal significativamente mais baixa e tiveram alterações microbianas e metabólicas na mesma linha que os doentes submetidos a uma EEN bem-sucedida. Este facto não foi observado nos doentes que não respeitaram a dieta. Com base nesses achados, poderia ser interessante usar fezes autólogas de pacientes com DC tratados com sucesso com EEN para FMT. O grupo de Schwerd analisou essa possibilidade usando FMT de cápsulas autólogas. Concluíram que esta abordagem não era adequada, uma vez que ainda existia uma carga patogénica demasiado elevada e uma diversidade microbiota demasiado baixa [9]. O grupo de Colónia apresentou um poster muito interessante sobre o acompanhamento de 2 casos de DII muito precoce refratária ao tratamento com esteroides e anti-TNFα. O primeiro doente tem colite ulcerosa e está agora há 3 anos em remissão total com a administração semanal de um enema de preparação de fezes de um dador. O segundo doente com DC está apenas em remissão parcial após um ano de seguimento [10].
Este resumo apresenta apenas uma panorâmica breve e selecionada das palestras, comunicações e posters do ESPGHAN. Muitos outros dados interessantes são apresentados sob a forma de resumos no Journal of Pediatric Gastroenterology. Os esforços combinados de investigadores científicos e clínicos continuarão a desvendar o mistério da microbiota intestinal e acabarão por trazer novas formas de tratar e prevenir doenças.
1. Szajewska H, Berni Canani R, Domellöf M, et al. Probiotics for the Management of Pediatric Gastrointestinal Disorders: Position Paper of the ESPGHAN Special Interest Group on Gut Microbiota and Modifications. J Pediatr Gastroenterol Nutr 2023; 76: 232-47
2. De Bruijn C, Zeevenhoven J, Vlieger A, et al. Efficacy of fecal microbiota transplantation in adolescents with refractory irritable bowel: a randomized, double-blind, placebo-controlled trial. J Pediatr Gastroenterol Nutr 2023; 76(S1 Suppl 1): 1-1407
3. Wang YZ, Xiao FF, Xiao YM, et al. Fecal microbiota transplantation relieves abdominal bloating in children with functional gastrointestinal disorders via modulating the gut microbiome and metabolome. J Dig Dis 2022; 23: 482-92
4. El-Salhy M, Winkel R, Casen C, et al. Efficacy of Fecal Microbiota Transplantation for Patients with Irritable Bowel Syndrome at 3 Years After Transplantation. Gastroenterology 2022; 163: 982-94.e14
5. Mahler T, Hoffman I, Smets F, et al. The Belgian consensus on irritable bowel syndrome: the paediatric gastroenterologist view. Acta Gastroenterol Belg 2022; 85: 384-6
6. Hurych J, Mascellani Bergo A, Lerchova T, et al. The faecal microbiome and metabolome changes in Crohn’s disease are associated with decreased mucosal inflammatory activity. J Pediatr Gastroenterol Nutr 2023; 76 (S1 Suppl 1): 1-1407
7. Schwerd S, Häcker D, Siebert K, et al. Exclusive enteral nutrition initiates protective functions in the gut microbiota and metabolome to induce remission in pediatric Crohn’s disease. J Pediatr Gastroenterol Nutr 2023; 76 (S1 Suppl 1): 1-1407
8. Macdonald J, Wilson D, Henderson P, Din S, e Chantges in faecal microbiome and metabolome are more pronounced in Crohn’s disease patients who adhered to the CD-TREAT diet and responded by calprotectin. J Pediatr Gastroenterol Nutr 2023; 76 (S1 Suppl 1): 1-1407
9. Hölz H, Heetmeyer J, Tsakmaklis A, et al . Autologous fecal microbiota transfer in pediatric Crohn ́s disease patients under treatment with exclusive enteral nutrition harbors major challenges - a feasibility test. J Pediatr Gastroenterol Nutr 2023; 76 (S1 Suppl 1): 1-1407
10. Fritz T, Huenseler C, Broekaert I. Safety and efficacy of long-term faecal microbiota transfer in very early onset inflammatory bowel disease. J Pediatr Gastroenterol Nutr 2023; 76 (S1 Suppl 1): 1-1407

