Основные новости 55-го конгресса Espghan
Д-р Таня Малер (Dr. Tania Mahler), MD
Эксперт в области детской гастроэнтерологии и питания, лечения хронической боли и функциональных расстройств желудочно-кишечного тракта, применения медицинского гипноза при функциональных расстройствах желудочно-кишечного тракта. Клинический консультант в детской университетской больнице королевы Фабиолы, Бельгия
Раздел для широкой публики
Найдите здесь свое выделенное место
en_sources_title
en_sources_text_start en_sources_text_end
Делиться - значит заботиться
Возможно, эта тема заинтересует ваших коллег. Почему бы не поделиться ею?
Разделы

Об этой статье
Очередной съезд ESPGHAN (Европейского общества детской гастроэнтерологии, гепатологии и питания), который состоялся в Вене в 2023 году, собрал 4300 участников со всего мира. После тяжелого периода пандемии Covid-19 это мероприятие стало источником вдохновения, поскольку участники смогли насладиться живыми выступлениями и личным общением, — более живым и продуктивным, чем виртуальное. Многие исследовательские группы сосредоточились на изучении микробиома кишечника у детей и представили интересные данные.
Влияние микробиома на здоровье и течение заболеваний давно не вызывает сомнений, теперь клиницисты и ученые ищут новые способы воздействия на микробиом или ранней диагностики болезней с помощью определенных микробных сигнатур. В этом обзоре освещены несколько важных и широко обсуждаемых тем.
Рекомендации по применению пробиотиков при некоторых заболеваниях желудочно-кишечного тракта у детей
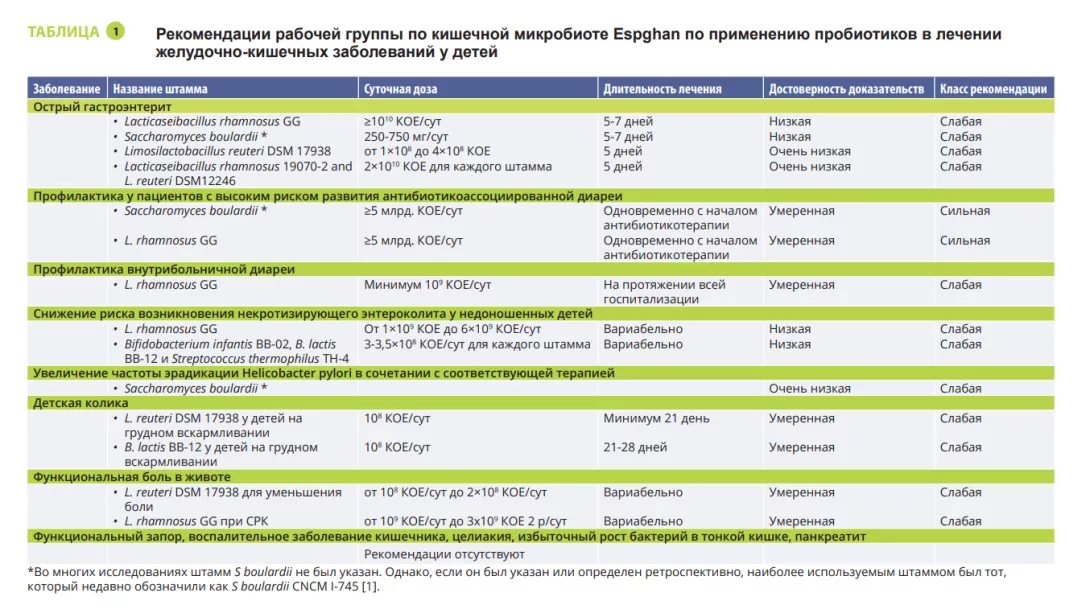
В феврале 2023 года специальная группа Espghan по кишечной микробиоте опубликовала рекомендации по использованию пробиотиков для лечения отдельных заболеваний желудочнокишечного тракта у детей, основанные на данных систематических обзоров и/ или метаанализов с использованием модифицированного процесса Delphi [1]. На заседании специальной группы по кишечной микробиоте и ее модификациям профессор Шаевска (Szajewska) представила результаты этой работы. Только несколько отдельных пробиотических штаммов доказали свою пользу в определенных условиях. В оригинальной статье [1] вы найдете полный обзор фактических рекомендаций.
ТФМ у подростков с рефрактерным СРК
Д-р Де Брейн (De Bruijn) из группы UMC в Амстердаме поделилась результатами высоко оцененной работы по исследованию эффективности ТФМ у подростков с рефрактерным СРК в ходе рандомизированного двойного слепого плацебо-контролируемого исследования [2]. Ее выступление было увлекательным, но вызвало много вопросов от аудитории после демонстрации слайда с пациентом во время процедуры трансплантации кала. Насколько нам известно, имеется другое педиатрическое исследование по оценке ТФМ при вздутии живота, — еще одном частом симптоме нарушенного взаимодействия между кишечником и мозгом при СРК [3].
Хроническая боль при СРК может очень сильно влиять на жизнь детей и взрослых, заставляя пропускать школу или работу, снижая качество жизни. Это многофакторное заболевание, возникновение которого лучше всего объясняется биопсихосоциальной моделью. Один из важнейших факторов — дисбиоз кишечной микробиоты. Различные исследования с участием взрослых показали эффективность ТФМ [4].
В педиатрии нефармакологические методы лечения, такие как образование, гипноз, осознанность, более эффективны, чем лекарственные препараты [5].
Однако, избавиться от симптомов не удается примерно у 25% пациентов. Для коррекции дисбиоза при СРК изучают различные пре-, про- и синбиотики. Полученные результаты довольно разнообразны. Переход на диету FODMAP также может повлиять на микрофлору желудочно-кишечного тракта [5]. В определенных группах пациентов ТФМ, при отсутствии противопоказаний, может быть единственным способом эффективно восстановить здоровый микробиом желудочно-кишечного тракта. В исследовании De Bruijn и соавт. приняли участие 32 пациента в возрасте от 16 лет до 21 года с рефрактерным СРК. Одна группа получила аллогенные (от здорового донора), а вторая — аутологичные (собственные) фекалии. Процедуру выполняли через назогастральный зонд дважды: на исходном уровне и через 6 недель. Клиническую эффективность определяли как долю пациентов со снижением тяжести СРК более чем на 50 пунктов по специальной шкале (IBSSSS). Через 12 недель и 6 месяцев после ТФМ оценивали состояние пациентов. На исходном уровне в обеих группах наблюдались сходные показатели шкалы IBS-SSS. После первой оценки статистически значимые различия отсутствовали, однако через 6 месяцев состояние пациентов после аллогенной ТФМ улучшилось на 60% по сравнению с 25% в группе аутологичной ТФМ (p = 0,048). Еще одним оцениваемым показателем было качество жизни, связанное со здоровьем (КЖСЗ). Общая оценка КЖСЗ на исходном уровне не различалась между группами, но значимо улучшилась после аллогенной ТФМ. Нежелательные явления отсутствовали. Аллогенная ТФМ выглядит многообещающим способом лечения рефрактерного СРК у молодых людей, но требует дополнительного изучения.
Микробиота и ВЗК
Группа гастроэнтерологов из Чехии представила результаты исследования, целью которого было установить, связаны ли изменения кишечной микробиоты при БК непосредственно с лечением анти-ФНОα или со снижением воспалительной активности в слизистой оболочке [6]. Для этого сравнили детей с активной болезнью Крона (БК) и ювенильным идиопатическим артритом (ЮИА), получавших лечение с помощью анти-ФНОα. Результаты показали, что заживление слизистой оболочки при БК очень важно для изменений со стороны бактериома. Лечение анти-ФНОα при ЮИА не ассоциировалось с изменениями бактериома. Schwerd и соавт. выполнили серийный анализ образцов кала у 20 детей с впервые диагностированной БК, чье первичное лечение включало исключительно энтеральное питание (ИЭП) [7]. У 15 из 20 пациентов наступила ремиссия. У них наблюдались четкие временные и индивидуальные изменения кишечной микробиоты и метаболитов в виде уменьшения численности Lachnospiraceae и роста концентрации ненасыщенных длинноцепочечных ж и р ныхкислот. Результ а т ы экспериментов с ферментацией ex vivo и переносом материала гнотобиотическим мышам показали более выраженный защитный эффект ИЭП - подобной среды по сравнению со средой на основе пищевых волокон и исходной микробиоты пациента. Авторы пришли к выводу, что ИЭП-модулированные микробиомы пациентов регулируют воспаление в кишечнике. Они также подробно рассказали о возможностях диет с низким содержанием клетчатки для индукции длительной ремиссии. Ученые из Великобритании в многоцентровом исследовании с участием детей и взрослых с болезнью Крона изучили вкусовые характеристики специальной диеты на основе твердой пищи (CDTREAT) и ее влияние на микробиоту и воспаление в кишечнике [8]. Диета подбиралась индивидуально дл я каждого пациента, но не включала определенные компоненты, такие как глютен, лактоза и алкоголь. У 55% пациентов такая диета ассоциировалась со значимо более низкими уровнями фекального кальпротектина и такими же изменениями микробиома и метаболизма, как при использовании ИЭП. Этого не наблюдалось у тех, кто не придерживался данной диеты. Авторы считают интересным изучить эффекты аутологичной ТФМ у пациентов с БК, которые достигли хороших результатов с помощью ИЭП. Группа ученых под руководством Schwerd проанализировала этот подход, используя ТФМ в виде капсул, и пришла к выводу о его нецелесообразности ввиду высокой патогенной нагрузки инизкого разнообразия микробиоты [9].
Исследователи из Кельна представили очень интересный постер с результатами наблюдения за 2 пациентами с очень ранним ВЗК, рефрактерным к стероидам и анти-ФНОα. Первый пациент с язвенным колитом уже 3 года находится в полной ремиссии, еженедельно получая донорские фекалии с помощью клизмы. Второму пациенту с БК в течение года удалось достичь лишь частичной ремиссии [10].
Мы верим, что совместный труд ученых и клиницистов позволит глубже раскрыть тайны кишечной микробиоты и приведет к разработке способов лечения и профилактики заболеваний.
1. Szajewska H, Berni Canani R, Domellöf M, et al. Probiotics for the Management of Pediatric Gastrointestinal Disorders: Position Paper of the ESPGHAN Special Interest Group on Gut Microbiota and Modifications. J Pediatr Gastroenterol Nutr 2023; 76: 232-47
2. De Bruijn C, Zeevenhoven J, Vlieger A, et al. Efficacy of fecal microbiota transplantation in adolescents with refractory irritable bowel: a randomized, double-blind, placebo-controlled trial. J Pediatr Gastroenterol Nutr 2023; 76(S1 Suppl 1): 1-1407
3. Wang YZ, Xiao FF, Xiao YM, et al. Fecal microbiota transplantation relieves abdominal bloating in children with functional gastrointestinal disorders via modulating the gut microbiome and metabolome. J Dig Dis 2022; 23: 482-92
4. El-Salhy M, Winkel R, Casen C, et al. Efficacy of Fecal Microbiota Transplantation for Patients with Irritable Bowel Syndrome at 3 Years After Transplantation. Gastroenterology 2022; 163: 982-94.e14
5. Mahler T, Hoffman I, Smets F, et al. The Belgian consensus on irritable bowel syndrome: the paediatric gastroenterologist view. Acta Gastroenterol Belg 2022; 85: 384-6
6. Hurych J, Mascellani Bergo A, Lerchova T, et al. The faecal microbiome and metabolome changes in Crohn’s disease are associated with decreased mucosal inflammatory activity. J Pediatr Gastroenterol Nutr 2023; 76 (S1 Suppl 1): 1-1407
7. Schwerd S, Häcker D, Siebert K, et al. Exclusive enteral nutrition initiates protective functions in the gut microbiota and metabolome to induce remission in pediatric Crohn’s disease. J Pediatr Gastroenterol Nutr 2023; 76 (S1 Suppl 1): 1-1407
8. Macdonald J, Wilson D, Henderson P, Din S, e Chantges in faecal microbiome and metabolome are more pronounced in Crohn’s disease patients who adhered to the CD-TREAT diet and responded by calprotectin. J Pediatr Gastroenterol Nutr 2023; 76 (S1 Suppl 1): 1-1407
9. Hölz H, Heetmeyer J, Tsakmaklis A, et al . Autologous fecal microbiota transfer in pediatric Crohn ́s disease patients under treatment with exclusive enteral nutrition harbors major challenges - a feasibility test. J Pediatr Gastroenterol Nutr 2023; 76 (S1 Suppl 1): 1-1407
10. Fritz T, Huenseler C, Broekaert I. Safety and efficacy of long-term faecal microbiota transfer in very early onset inflammatory bowel disease. J Pediatr Gastroenterol Nutr 2023; 76 (S1 Suppl 1): 1-1407

