55º encuentro anual de la Espghan
Por la Dra. Tania Mahler
Dolor crónico y trastornos digestivos funcionales, Médica adjunta en el Hospital Universitario Infantil Reina Fabiola, Bélgica
Espacio para el público general
Encuentra aquí tu espacio dedicado
en_sources_title
en_sources_text_start en_sources_text_end
Capítulos

Acerca de este artículo
En el encuentro de la Espghan (Sociedad Europea de Gastroenterología, Hepatología y Nutrición Pediátrica) de 2023 celebrado en Viena, se reunieron 4300 participantes de todo el mundo. Tras el complicado período de la pandemia de Covid-19, este evento ha supuesto una bocanada de aire fresco, ya que los participantes pudieron asistir a presentaciones en directo y tener conversaciones cara a cara. Estas interacciones en persona han resultado mucho más agradables y enriquecedoras que las alternativas virtuales. Varios grupos de investigación centraron su trabajo en el microbioma intestinal y presentaron datos relevantes en el campo de la pediatría.
El impacto del microbioma en la salud y en la enfermedad está ampliamente reconocido, por lo que es lógico que tanto pediatras como investigadores en pediatría intenten entender mejor cómo podemos manipular el microbioma y cómo podemos detectar una enfermedad en su fase temprana utilizando la firma del microbioma. El objetivo de este resumen es arrojar luz sobre varios temas clave que se trataron profusamente.
Recomendaciones para el uso de probióticos en trastornos digestivos pediátricos seleccionados
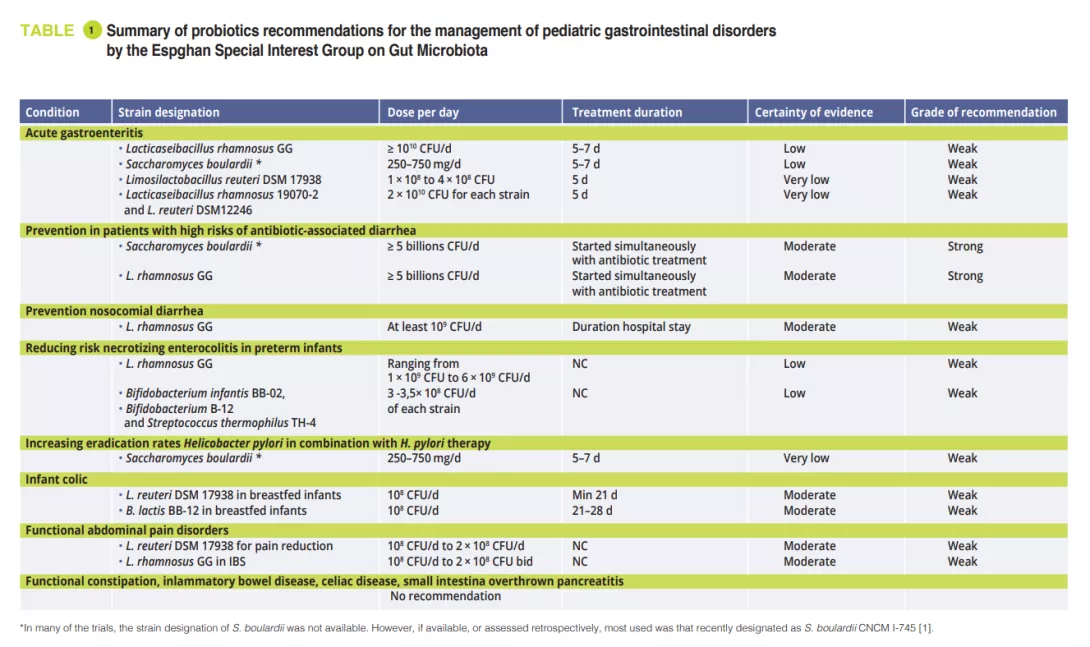
En febrero de 2023, el grupo de interés especial de la Espghan sobre la microbiota intestinal publicó unas recomendaciones para el uso de probióticos en el abordaje de trastornos digestivos pediátricos seleccionados, basadas en revisiones sistemáticas y/o metanálisis mediante el proceso Delphi modificado [1]. En la reunión del grupo de interés especial sobre microbiota intestinal y modificaciones, la profesora Szajewska nos mostró los resultados de este trabajo. Solo se ha demostrado la utilidad de algunas cepas probióticas específicas en determinadas condiciones. En el artículo original [1] se puede encontrar una descripción clara de las recomendaciones precisas.
TMF en adolescentes con SII resistente al tratamiento
La Dra. De Bruijn, del grupo de investigación de la Amsterdam UMC presentó, en la sesión plenaria sobre el resumen mejor puntuado, su estudio sobre la eficacia del TMF en adolescentes con SII resistente al tratamiento en un ensayo aleatorizado controlado con placebo y con doble ciego [2]. Su charla fue fascinante, pero también provocó muchas reacciones entre el público cuando proyectó una diapositiva de un paciente que recibía una inyección de materia fecal. Hasta donde sabemos, solo otro estudio pediátrico había evaluado el alivio de la distensión abdominal mediante TMF, otro signo de los trastornos en la interacción intestino-cerebro y que suele presentarse en el SII [3].
El dolor crónico en el SII puede tener un impacto enorme en la actividad de niños y adultos, y desembocar en absentismo escolar y laboral y en una mala calidad de vida. El origen de la enfermedad es multifactorial y se puede explicar mejor mediante el modelo biopsicosocial. Uno de los factores clave es la disbiosis de la microbiota intestinal. En adultos se han publicado diferentes estudios sobre el efecto positivo observado con el TMF [4].
En pediatría, tratamientos no farmacológicos como la información, la hipnosis y el mindfulness son más eficaces que los tratamientos farmacológicos [5]. Aun así, los síntomas se mantienen en aproximadamente el 25 % de los pacientes. Se han probado prebióticos, probióticos y simbióticos con distintos resultados para corregir la disbiosis en el SII. El cambio a una dieta FODMAP también puede influir en la flora gastrointestinal [5]. Pero en grupos específicos de pacientes, el TMF - siempre que sea seguro - podría ser el tratamiento definitivo para restablecer de manera eficaz un microbioma gastrointestinal sano. En el estudio de De Bruijn et al., se seleccionaron y aleatorizaron 32 pacientes con SII resistente al tratamiento de entre 16 y 21 años. Un grupo recibió instilaciones fecales alogénicas (donante sano) y el otro grupo autólogas (propias) mediante sonda nasogástrica al inicio y 6 semanas después. La eficacia clínica se definió como la proporción de pacientes con una reducción de más de 50 puntos en el Sistema de Puntuación de la Gravedad del SII (SPG-SII). Se evaluó a los pacientes 12 semanas y 6 meses después del TMF. Ambos grupos presentaron una puntuación similar en el SPG-SII al inicio. Después de la primera evaluación no hubo diferencias estadísticas, pero a los 6 meses del seguimiento hubo mejoría en el 60 % de los pacientes que recibieron un TMF alogénico frente al 25 % del grupo autólogo (p = 0,048). La calidad de vida relacionada con la salud (CDV) era uno de los beneficios secundarios. No hubo diferencias en la puntuación total de CDV entre ambos grupos al inicio, pero mejoró de manera significativa tras el TMF alogénico. No se registraron acontecimientos adversos. El TMF alogénico parece ser una manera interesante de tratar el SII resistente al tratamiento entre los jóvenes, pero es necesario hacer más estudios.
Microbiota y enfermedades inflamatorias intestinales
En la sesión de gastroenterología sobre la enfermedad del intestino irritable (EII), un grupo checo presentó un estudio cuyo objetivo era evaluar si los cambios en la microbiota en la enfermedad de Crohn activa (EC) se debían al tratamiento anti-TNFα o si eran el resultado de una menor actividad inflamatoria de la mucosa [6]. Para ello, compararon a niños bajo tratamiento anti-TNFα con EC o con artritis idiopática juvenil (AIJ). Los resultados mostraron que la cicatrización de la mucosa en la EC era fundamental para conseguir cambios en el bacterioma. El tratamiento anti-TNFα en la AIJ no tuvo ninguna repercusión en el bacterioma de este grupo de pacientes. Schwerd et al. hicieron un seguimiento de 20 pacientes pediátricos con EC recién diagnosticada que recibieron primero un tratamiento con nutrición enteral exclusiva con (NEE) con muestras de heces [7]. La enfermedad remitió en quince de veinte pacientes. Se observaron cambios claros temporales e individuales en la microbiota intestinal y los metabolitos, con una menor abundancia de Lachnospiraceae y un incremento de los ácidos grasos insaturados de cadena larga. La fermentación ex vivo con medios similares a la NEE y su posterior transferencia en modelos murinos gnotobióticos mostró un efecto protector en contraste con los medios ricos en fibra y con los colonizados directamente con la microbiota inicial del paciente. Basándose en esos resultados, llegaron a la conclusión de que los microbiomas de los pacientes modulados con NEE regulan la inflamación intestinal. Además, explicaron detalladamente la posibilidad de recurrir a una dieta baja en fibra para la remisión a largo plazo. Un estudio multicéntrico realizado en el Reino Unido (en niños y adultos) estudió la posibilidad de utilizar una dieta de alimentos sólidos para tratar la enfermedad de Crohn (CD-TREAT) con la finalidad de elaborar una dieta más sabrosa que pudiera influir en la inflamación intestinal modificando las bacterias intestinales [8]. La dieta se personalizó para cada paciente, pero excluyó componentes alimenticios concretos, como el gluten, la lactosa o el alcohol. El 55 % de los pacientes que siguieron este régimen presentaron una calprotectina fecal significativamente inferior, además de cambios microbianos y metabólicos en la misma línea que los pacientes que siguieron una NEE satisfactoria. Esto no se observó en los pacientes que no respetaron la dieta. A partir de estos hallazgos, podría ser interesante utilizar heces autólogas de pacientes tratados satisfactoriamente con NEE para el TMF. El grupo de Schwerd analizó esta posibilidad mediante cápsulas de TMF autólogo. Llegaron a la conclusión de que este planteamiento no era adecuado, ya que seguía habiendo una carga de patógenos demasiado elevada y una diversidad de la microbiota demasiado baja [9].
El grupo de Colonia presentó un poster muy interesante sobre el seguimiento de 2 casos de EII muy temprana resistente a los esteroides y al tratamiento antiTNFα. El primer paciente tiene colitis ulcerosa y actualmente lleva 3 años en remisión total con la administración semanal de un edema con una preparación de heces de donante. El segundo paciente, con EC, se encuentra solo en remisión parcial después de un año de seguimiento [10].
Este resumen ha dado un breve repaso de una selección de charlas, comunicaciones y pósteres de la Espghan. En el Journal of Pediatric Gastroenterology se recogen muchos otros datos interesantes en forma de resúmenes. Los esfuerzos conjuntos de los investigadores y de los médicos seguirán desentrañando el misterio de la microbiota intestinal, para acabar aportando nuevas maneras de tratar y prevenir enfermedades.
1. Szajewska H, Berni Canani R, Domellöf M, et al. Probiotics for the Management of Pediatric Gastrointestinal Disorders: Position Paper of the ESPGHAN Special Interest Group on Gut Microbiota and Modifications. J Pediatr Gastroenterol Nutr 2023; 76: 232-47
2. De Bruijn C, Zeevenhoven J, Vlieger A, et al. Efficacy of fecal microbiota transplantation in adolescents with refractory irritable bowel: a randomized, double-blind, placebo-controlled trial. J Pediatr Gastroenterol Nutr 2023; 76(S1 Suppl 1): 1-1407
3. Wang YZ, Xiao FF, Xiao YM, et al. Fecal microbiota transplantation relieves abdominal bloating in children with functional gastrointestinal disorders via modulating the gut microbiome and metabolome. J Dig Dis 2022; 23: 482-92
4. El-Salhy M, Winkel R, Casen C, et al. Efficacy of Fecal Microbiota Transplantation for Patients with Irritable Bowel Syndrome at 3 Years After Transplantation. Gastroenterology 2022; 163: 982-94.e14
5. Mahler T, Hoffman I, Smets F, et al. The Belgian consensus on irritable bowel syndrome: the paediatric gastroenterologist view. Acta Gastroenterol Belg 2022; 85: 384-6
6. Hurych J, Mascellani Bergo A, Lerchova T, et al. The faecal microbiome and metabolome changes in Crohn’s disease are associated with decreased mucosal inflammatory activity. J Pediatr Gastroenterol Nutr 2023; 76 (S1 Suppl 1): 1-1407
7. Schwerd S, Häcker D, Siebert K, et al. Exclusive enteral nutrition initiates protective functions in the gut microbiota and metabolome to induce remission in pediatric Crohn’s disease. J Pediatr Gastroenterol Nutr 2023; 76 (S1 Suppl 1): 1-1407
8. Macdonald J, Wilson D, Henderson P, Din S, e Chantges in faecal microbiome and metabolome are more pronounced in Crohn’s disease patients who adhered to the CD-TREAT diet and responded by calprotectin. J Pediatr Gastroenterol Nutr 2023; 76 (S1 Suppl 1): 1-1407
9. Hölz H, Heetmeyer J, Tsakmaklis A, et al . Autologous fecal microbiota transfer in pediatric Crohn ́s disease patients under treatment with exclusive enteral nutrition harbors major challenges - a feasibility test. J Pediatr Gastroenterol Nutr 2023; 76 (S1 Suppl 1): 1-1407
10. Fritz T, Huenseler C, Broekaert I. Safety and efficacy of long-term faecal microbiota transfer in very early onset inflammatory bowel disease. J Pediatr Gastroenterol Nutr 2023; 76 (S1 Suppl 1): 1-1407

