Points clés du 55e congrès de l’Espghan
Par le Dr Tania Mahler
Docteur en médecine, gastro-entérologie et nutrition pédiatrique, Adjointe clinique à l’Hôpital universitaire des enfants Reine Fabiola, Belgique
Section grand public
Retrouvez ici votre espace dédié
en_sources_title
en_sources_text_start en_sources_text_end
Chapitres

A propos de cet article
4 300 participants du monde entier se sont réunis au congrès 2023 de l’Espghan (European Society of Pediatric Gastroenterology Hepatology and Nutrition), tenu à Vienne. Suivant la période difficile de la pandémie de Covid-19, cet événement a offert une expérience revitalisante au cours de laquelle les participants pouvaient assister à des présentations en direct et avoir des discussions en face à face. Cette interaction en personne s’est avérée être significativement plus agréable et enrichissante que les événements virtuels. Divers groupes de recherche ont axé leur travail sur le microbiome intestinal et ont présenté des données convaincantes dans le domaine de la pédiatrie.
L’impact du microbiome sur la santé et les maladies est largement reconnu ; il est donc évident que les cliniciens et les chercheurs en pédiatrie essayent d’accéder à une meilleure compréhension de la façon dont nous pouvons manipuler le microbiome et, en utilisant la signature du microbiome, détecter la maladie à un stade précoce. Cette revue vise à mettre en lumière plusieurs sujets clés ayant été longuement discutés.
Recommandations concernant l’utilisation de probiotiques pour certains troubles pédiatriques gastro-intestinaux
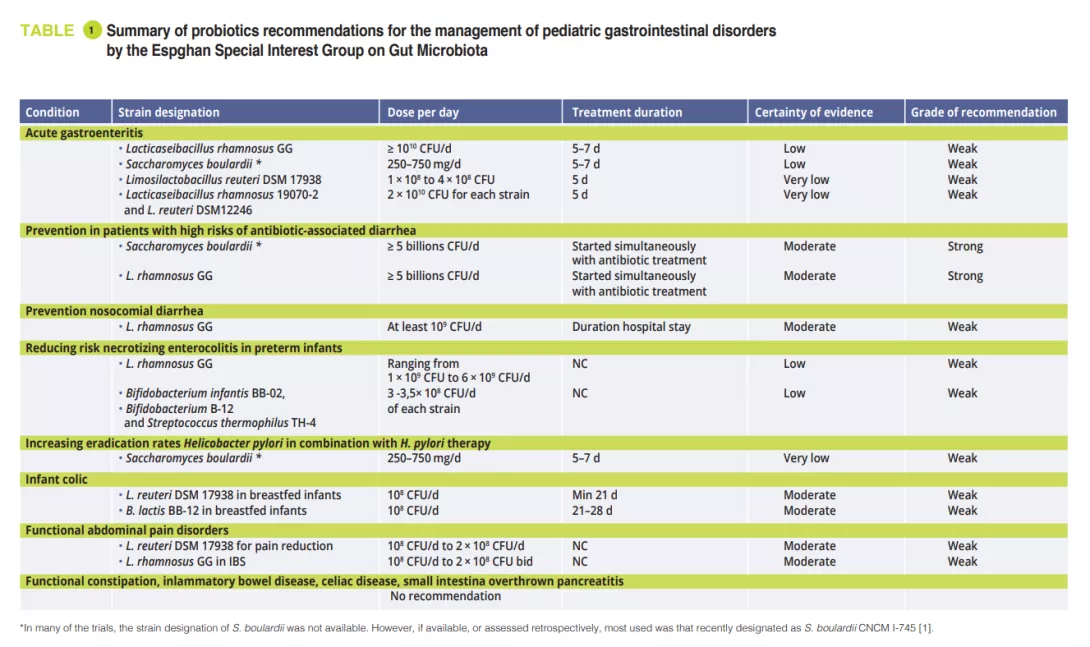
En février 2023, le groupe de l’Espghan s’intéressant spécifiquement au microbiote intestinal a publié des recommandations pour l’utilisation de probiotiques dans la gestion de certains troubles pédiatriques gastro-intestinaux, en s’appuyant sur des revues systématiques et/ ou des méta-analyses utilisant la méthode de Delphes modifiée [1]. Lors du rassemblement du groupe d’intérêt spécial concernant le microbiote intestinal et ses modifications, le professeur Szajewska nous a montré les résultats de ce travail. Seules quelques souches de probiotiques spécifiques démontrent une utilité dans certaines conditions.
TMF chez des adolescents présentant un SII réfractaire
Lors de la session plénière sur le résumé au score le plus élevé, le Dr De Bruijn, du groupe de l’Amsterdam UMC, a présenté l’étude du groupe sur l’efficacité de la TMF chez les adolescents présentant un SII réfractaire dans un essai randomisé en double aveugle contrôlé versus placebo [2]. Sa présentation était captivante, mais a également suscité beaucoup de réactions dans l’audience lors de l’affichage d’une diapositive montrant un patient recevant des seringues contenant de la matière fécale. À notre connaissance, seule une autre étude pédiatrique a évalué la TMF pour le soulagement des ballonnements abdominaux, une autre caractéristique des troubles de l’interaction intestin-cerveau souvent présente dans le SII [3].
La douleur chronique due au SII peut avoir un impact énorme sur la vie des enfants et des adultes, entraîner de l’absentéisme à l’école et au travail et dégrader la qualité de vie. L’origine de la maladie est multifactorielle et peut s’expliquer par un modèle biopsychosocial. L’un des facteurs jouant un rôle clé est la dysbiose du microbiote intestinal. Chez les adultes, différentes études sur les effets positifs constatés de la TMF ont été publiées [4].
En pédiatrie, les traitements non pharmacologiques comme l’éducation, l’hypnose et la pleine conscience sont plus efficaces que les traitements pharmacologiques [5]. Mais les symptômes persistent chez environ 25 % des patients. Les prébiotiques, probiotiques et symbiotiques sont testés en fonction de divers résultats pour corriger la dysbiose dans le SII. Passer à un régime pauvre en FODMAP peut également influencer la flore gastro-intestinale [5]. Mais chez des groupes de patients spécifiques, la TMF pourrait, si elle est sans danger, représenter un traitement définitif pour restaurer efficacement un microbiome gastro-intestinal sain. Dans l’étude de De Bruijn et al., 32 patients âgés de 16 à 21 ans présentant un SII réfractaire ont été recrutés et randomisés. Un groupe a reçu des perfusions fécales allogènes (issues d’un donneur sain) et l’autre groupe a reçu des perfusions fécales autologues (issues du patient luimême) par une sonde naso-gastrique au début de l’étude, puis 6 semaines plus tard. L’efficacité clinique a été définie par la proportion de patients présentant une réduction de plus de 50 points dans le système de notation de la gravité du SII (IBS-SSS). Les patients ont été évalués 12 semaines et 6 mois après la TMF. Les deux groupes avaient des scores d’IBSSSS similaires au début de l’étude. Après la première évaluation, aucune différence statistique n’a été observée, mais au bout de 6 mois de suivi, 60 % des patients ayant reçu la TMF allogène présentaient une amélioration, contre 25 % dans le groupe autologue (p = 0,048). Le deuxième résultat incluait la qualité de vie (QdV) liée à la santé. Le score de QdV total au début de l’étude était semblable dans les deux groupes, mais s’est significativement amélioré après la TMF allogène. Aucun effet indésirable n’a été enregistré. La TMF allogène semble être une façon efficace de traiter le SII réfractaire chez les jeunes, mais des études complémentaires sont nécessaires.
Microbiote et SII
Lors de la session de gastro-entérologie sur le SII, un groupe tchèque a présenté une étude ayant pour but d’évaluer si les changements de microbiote dans la maladie de Crohn étaient dus au traitement anti-TNFα ou étaient le résultat d’une activité mucosale inflammatoire [6]. Il a donc comparé des enfants recevant le traitement anti-TNFα avec la maladie de Crohn (MC) active et avec de l’arthrite juvénile idiopathique (AJI). Les résultats indiquent que la guérison mucosale avec la MC était essentielle pour obtenir un changement dans le bactériome. Le traitement anti-TNFα avec l’AJI n’a eu aucun impact sur le bactériome de ce groupe de patients. Schwerd et al. ont suivi 20 patients pédiatriques ayant récemment reçu un diagnostic de MC et traités avec une nutrition entérale exclusive (NEE), avec échantillonnage de selles [7]. Quinze patients sur les vingt sont entrés en rémission. Ils ont démontré de nets changements temporels et individuels dans le microbiome intestinal et les métabolites, avec une réduction de l’abondance de Lachnospiraceae et des acides gras à longue chaîne insaturés enrichis. La fermentation ex vivo avec un milieu similaire à la NEE et le transfert ultérieur dans des modèles murins gnotobiotiques ont montré un effet protecteur, par contraste avec le milieu riche en fibres et avec les milieux colonisés directement avec le microbiote du patient au début de l’étude. En s’appuyant sur ces résultats, les chercheurs ont conclu que les microbiomes des patients modulés par la NEE régulent l’inflammation intestinale. Ils ont également abordé la possibilité d’utiliser une alimentation pauvre en fibres pour les rémissions à long terme. Une étude multicentrique au Royaume-Uni (enfants et adultes) a étudié la possibilité d’utiliser le régime d’aliments solides Crohn’s Disease TReatment-with-EATing (CDTREAT) pour obtenir une alimentation plus appétissante, mais pouvant influencer l’inflammation intestinale en changeant les bactéries intestinales [8]. Le régime est adapté à chaque patient, mais exclut des composants alimentaires spécifiques comme le gluten, le lactose et l’alcool. Les 55 % des patients ayant adhéré à ce régime présentaient un niveau significativement plus faible de calprotectine fécale et ont obtenu des changements microbiens et métaboliques dans la même lignée que ceux des patients suivant une NEE avec succès. Ces changements n’ont pas été observés chez ceux qui ne respectaient pas le régime. Sur la base de ces résultats, il pourrait être intéressant d’utiliser de la matière fécale autologue de patients atteints de la MC traités avec la NEE pour la FMT. Le groupe de Schwerd a analysé cette possibilité en utilisant une FMT autologue par capsule. Les chercheurs ont conclu que cette approche n’était pas adéquate étant donné qu’il existait encore un fardeau pathogène élevé et une faible diversité dans le microbiote [9].
Le groupe de Cologne a présenté une affiche très intéressante sur le suivi de 2 cas de MII très précoces réfractaires aux stéroïdes et au traitement anti-TNFα. Le premier patient présentait une colite ulcéreuse et est maintenant en rémission totale depuis 3 ans, en recevant chaque semaine un lavement à partir d’une préparation réalisée avec la matière fécale d’un donneur. Le deuxième patient atteint de la MC n’est qu’en rémission partielle, après un an de suivi [10]. Ce résumé ne donne qu’un aperçu court et sélectif des discussions, communications et affiches de l’Espghan. De nombreuses autres données intéressantes sont disponibles sous forme de résumé dans le Journal of Pediatric Gastroenterology. Les efforts combinés des chercheurs et des cliniciens continueront de les aider à découvrir les mystères du microbiote intestinal pour pouvoir nous indiquer de nouvelles façons de traiter et de prévenir les maladies.
1. Szajewska H, Berni Canani R, Domellöf M, et al. Probiotics for the Management of Pediatric Gastrointestinal Disorders: Position Paper of the ESPGHAN Special Interest Group on Gut Microbiota and Modifications. J Pediatr Gastroenterol Nutr 2023; 76: 232-47
2. De Bruijn C, Zeevenhoven J, Vlieger A, et al. Efficacy of fecal microbiota transplantation in adolescents with refractory irritable bowel: a randomized, double-blind, placebo-controlled trial. J Pediatr Gastroenterol Nutr 2023; 76(S1 Suppl 1): 1-1407
3. Wang YZ, Xiao FF, Xiao YM, et al. Fecal microbiota transplantation relieves abdominal bloating in children with functional gastrointestinal disorders via modulating the gut microbiome and metabolome. J Dig Dis 2022; 23: 482-92
4. El-Salhy M, Winkel R, Casen C, et al. Efficacy of Fecal Microbiota Transplantation for Patients with Irritable Bowel Syndrome at 3 Years After Transplantation. Gastroenterology 2022; 163: 982-94.e14
5. Mahler T, Hoffman I, Smets F, et al. The Belgian consensus on irritable bowel syndrome: the paediatric gastroenterologist view. Acta Gastroenterol Belg 2022; 85: 384-6
6. Hurych J, Mascellani Bergo A, Lerchova T, et al. The faecal microbiome and metabolome changes in Crohn’s disease are associated with decreased mucosal inflammatory activity. J Pediatr Gastroenterol Nutr 2023; 76 (S1 Suppl 1): 1-1407
7. Schwerd S, Häcker D, Siebert K, et al. Exclusive enteral nutrition initiates protective functions in the gut microbiota and metabolome to induce remission in pediatric Crohn’s disease. J Pediatr Gastroenterol Nutr 2023; 76 (S1 Suppl 1): 1-1407
8. Macdonald J, Wilson D, Henderson P, Din S, e Chantges in faecal microbiome and metabolome are more pronounced in Crohn’s disease patients who adhered to the CD-TREAT diet and responded by calprotectin. J Pediatr Gastroenterol Nutr 2023; 76 (S1 Suppl 1): 1-1407
9. Hölz H, Heetmeyer J, Tsakmaklis A, et al . Autologous fecal microbiota transfer in pediatric Crohn ́s disease patients under treatment with exclusive enteral nutrition harbors major challenges - a feasibility test. J Pediatr Gastroenterol Nutr 2023; 76 (S1 Suppl 1): 1-1407
10. Fritz T, Huenseler C, Broekaert I. Safety and efficacy of long-term faecal microbiota transfer in very early onset inflammatory bowel disease. J Pediatr Gastroenterol Nutr 2023; 76 (S1 Suppl 1): 1-1407

