L’indole-3-acétique (3-IAA) dérivé du microbiote intestinal influence l’efficacité de la chimiothérapie dans le cancer du pancréas
ARTICLE COMMENTÉ - Rubrique adulte
Par le Pr Harry Sokol
Gastro-entérologie et nutrition, Hôpital Saint-Antoine, Paris, France
Section grand public
Retrouvez ici votre espace dédié
en_sources_title
en_sources_text_start en_sources_text_end
Chapitres
A propos de cet article
Auteur
Commentaire de l’article de Tintelnot et al. Nature 2023 [1]
L’adénocarcinome canalaire pancréatique (PDAC) devrait être le deuxième cancer le plus meurtrier d’ici 2040, en raison de l’incidence élevée de la maladie métastatique et des réponses limitées au traitement. Moins de la moitié des patients répondent à la chimiothérapie, traitement principal du PDAC, et les variations génétiques des patients ne suffisent pas à expliquer ces différences de réponse. L’alimentation est un des facteurs environnementaux qui pourrait influencer la réponse aux thérapies, cependant son rôle dans la PDAC n’est pas clair. Ici, en utilisant le séquençage métagénomique et un criblage métabolomique, les auteurs ont montré que l’acide indole-3-acétique (3-IAA), un métabolite du tryptophane dérivé du microbiote, est enrichi chez les patients qui répondent au traitement. La transplantation de microbiote fécal, des interventions diététiques avec du tryptophane et l’administration orale de 3-IAA augmentent l’efficacité de la chimiothérapie dans des modèles murins humanisés de PDAC. En utilisant une combinaison d’expériences de perte et de gain de fonction, les auteurs ont montré que l’efficacité du 3-IAA et de la chimiothérapie requière la présence de la myéloperoxydase (MPO) issue des neutrophiles. La MPO oxyde le 3-IAA qui, en combinaison avec la chimiothérapie, induit une régulation à la baisse des enzymes dégradant les espèces réactives de l’oxygène (ROS), la glutathion peroxydase 3 et la glutathion peroxydase 7. Tout cela entraîne une accumulation de ROS et une régulation négative de l’autophagie dans les cellules cancéreuses, ce qui compromet leur capacité métabolique et, en fin de compte, leur prolifération. Chez l’homme, les auteurs ont observé une corrélation significative entre les niveaux de 3-IAA et l’efficacité de la thérapie dans deux cohortes indépendantes de PDAC. En résumé, les auteurs ont identifié un métabolite dérivé du microbiote qui a des implications cliniques dans le traitement du PDAC, et ils fournissent une motivation pour envisager des interventions nutritionnelles pendant le traitement des patients atteints de cancer.
Que sait-on déjà à ce sujet ?
La polychimiothérapie, soit avec le 5-fluoro-uracile (5-FU), l’irinotécan et l’oxaliplatine en combinaison avec l’acide folinique (FOLFIRINOX), soit avec la gemcitabine et le nabpaclitaxel (GnP), est considérée comme la norme de soins pour les patients souffrant d’un PDAC métastatique (mPDAC). Cependant, moins de la moitié des patients répondent à la thérapie, et les patients qui ne répondent pas (patients non répondeur, NR) meurent en quelques semaines dans un tableau douloureux. Les altérations génétiques du PDAC expliquent mal les différences entre les patients qui répondent au traitement (patients répondeurs (R)) et les patients NR, ce qui laisse les facteurs environnementaux, y compris le microbiote intestinal, comme médiateurs potentiels de l’efficacité de la chimiothérapie. Il est donc urgent d’identifier les facteurs environnementaux qui pourraient expliquer les différences entre les patients R et NR afin de développer de nouveaux concepts pour les thérapies futures. Il a été démontré que le microbiote intestinal est impliqué dans la réponse à l’immunothérapie chez les patients atteints de mélanome et de nombreux autres cancers et qu’il peut être modulé par l’alimentation [2, 3]. Chez de rares patients atteints de PDAC localisé et survivants à long terme, les bactéries peuvent passer de l’intestin à la tumeur et contrôler l’activation immunitaire antitumorale. Cependant, la plupart des patients souffrant d’un PDAC agressif et résistant à l’immunothérapie sont traités par polychimiothérapie, et on ne sait pas encore si et comment le microbiote ou les habitudes alimentaires influencent son efficacité [4].
- Le microbiote intestinal est différent chez les patients avec PDAC répondeurs et non répondeurs à la chimiothérapie
- Le métabolite du tryptophane 3-IAA, produit par le microbiote, est enrichi chez les patients répondeurs
- Le 3-IAA augmente l’efficacité de la chimiothérapie en augmentant la production de ROS par les neutrophiles et en diminuant l’autophagie dans les cellules cancéreuses
Quels sont les principaux résultats apportés par cette étude ?
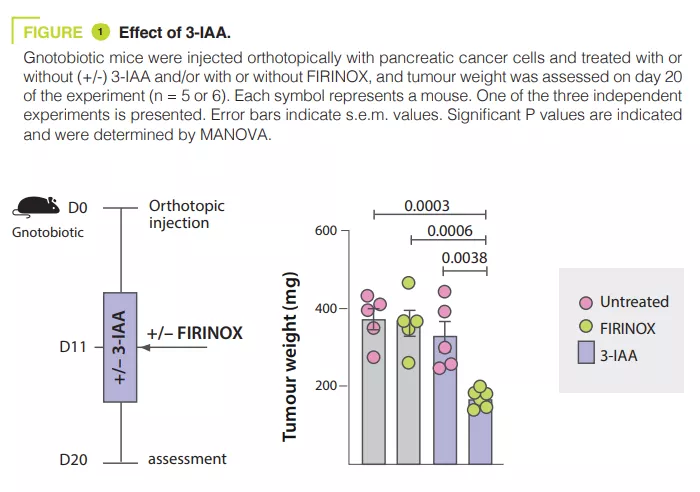
L’analyse du microbiote de 30 patients atteints de mPDAC a révélé des différences entre les patients R et les NR. Le transfert du microbiote des R à des souris porteuses de tumeurs pancréatiques a permis de réduire la taille des tumeurs après la chimiothérapie. Le métabolite du tryptophane 3-IAA était enrichi chez les patients R et les souris avec un microbiote R, contribuant potentiellement à la réponse à la chimiothérapie. L’administration de 3-IAA améliorait l’efficacité de la chimiothérapie chez les souris (figure 1). L’analyse des cellules immunitaires chez les souris a montré une augmentation des cellules T CD8+ et une diminution des neutrophiles chez les souris ayant un microbiote associé à une bonne réponse à la chimiothérapie. Le 3-IAA affectait la MPO des neutrophiles, réduisant ainsi leur survie. La combinaison du 3-IAA et de la chimiothérapie réduisait le nombre des neutrophiles et inhibait la croissance de la tumeur, la MPO jouant un rôle crucial. Il a été suggéré que la MPO induisait la production de ROS, conduisant à la mort cellulaire pendant la chimiothérapie. Des expériences in vitro ont montré que le 3-IAA augmentait les niveaux de ROS. Cet effet a été confirmé in vivo et l’inhibition des ROS par la N-acétylcystéine éliminait l’efficacité de FIRINOX chez les souris présentant des niveaux élevés de 3-IAA. Les auteurs ont ensuite montré que l’effet du 3-IAA était lié à une régulation négative de l’autophagie. Enfin, des concentrations sériques élevées de 3-IAA étaient corrélées avec une diminution du nombre de neutrophiles et une amélioration de la survie dans deux cohortes de patients humains.
Quelles sont les conséquences en pratique ?
Le microbiote intestinal a un effet sur la réponse à la chimiothérapie. Parmi les mécanismes impliqués cette étude démontre le rôle des métabolites microbiens et particulièrement des métabolites du tryptophane. Parmi eux, le 3-IAA est non seulement un marqueur prédictif de la réponse à la chimiothérapie dans le PDAC, mais il pourrait également représenter une molécule thérapeutique adjuvante.
CONCLUSION
Le microbiote intestinal a un effet sur la réponse à la chimiothérapie dans le PDAC. Un de ses métabolite, le 3-IAA, est prédictif d’une bonne réponse à la chimiothérapie et augmente son effet via l’induction d’une accumulation de ROS et la diminution de l’autophagie des cellules cancéreuses
1.Tintelnot J, Xu Y, Lesker TR, et al. Microbiota-derived 3-IAA influences chemotherapy efficacy in pancreatic cancer. Nature 2023 ; 615 : 168-74.
2. Baruch EN, Youngster I, Ben-Betzalel G, et al. Fecal microbiota transplant promotes response in immunotherapy-refractory melanoma patients. Science 2021 ; 371 : 602-9.
3. Spencer CN, McQuade JL, Gopalakrishnan V, et al. Dietary fiber and probiotics influence the gut microbiome and melanoma immunotherapy response. Science 2021 ; 374 : 1632-40.
4. Thomas RM, Jobin, C. Microbiota in pancreatic health and disease: the next frontier in microbiome research. Nat Rev Gastroenterol Hepatol 2020 ; 17 : 53-64.


