3-ИУК (индол-3-уксусная кислота), продуцируемая микробиотой, влияет на эффективность химиотерапии при раке поджелудочной железы
КОММЕНТАРИИ К СТАТЬЕ
Проф. Гарри Сокол (Harry Sokol)
Отделение гастроэнтерологии и нутрициологии, больница Сен-Антуан, Париж, Франция
Раздел для широкой публики
Найдите здесь свое выделенное место
en_sources_title
en_sources_text_start en_sources_text_end
Делиться - значит заботиться
Возможно, эта тема заинтересует ваших коллег. Почему бы не поделиться ею?
Разделы
Об этой статье
Автор
Комментарии к статье Tintelnot et al. Nature 2023 [1]
Ожидается, что к 2040 году протоковая аденокарцинома поджелудочной железы (ПАПЖ) станет вторым наиболее летальным онкологическим заболеванием из-за высокой частоты метастазирования и ограниченного ответа на лечение. Менее половины пациентов с ПАПЖ отвечают на первичное лечение, и только генетические нарушения не могут в достаточной степени объяснить различия в ответах. Питание является одним из факторов, который может влиять на ответ на лечение, но его роль при ПАПЖ неясна. Авторы исследования, используя метагеномное секвенирование методом дробовика и метаболический скрининг, показали, что уровень метаболита триптофана, индол-3-уксусной кислоты (3-ИУК), продуцируемой микробиотой, более высокий у пациентов, отвечающих на лечение. Трансплантация фекальной микробиоты, изменение потребления триптофана с пищей и прием 3-ИУК повышают эффективность химиотерапии в мышиной модели человеческой ПАПЖ. Используя метод экспериментального модулирования функциональной активности, авторы показали, что эффективность 3-ИУК и химиотерапии зависит от присутствия миелопероксидазы (МПО) нейтрофилов. МПО окисляет 3-ИУК, которая в сочетании с химиотерапией снижает экспрессию ферментов глутатионпероксидазы 3 и глутатионпероксидазы 7, инактивирующих активные формы кислорода (АФК). Все это приводит к накоплению АФК и подавлению аутофагии в раковых клетках, что нарушает их метаболическую активность и, в конечном итоге, пролиферацию. У человека авторы наблюдали значимую корреляцию между уровнями 3-ИУК и эффективностью терапии в двух независимых когортах пациентов с ПАПЖ. Таким образом, авторы идентифицировали метаболит, продуцируемый микробиотой, подходящий для использования в клинической практике у пациентов с ПАПЖ, и показали возможность использования коррекции питания при лечении онкологических больных.
Что мы уже знаем?
Полихимиотерапия с использованием 5-фторурацила (5-ФУ), иринотекана и оксалиплатина в комбинациис фолиновой кислотой (FOLFIRINOX) или гемцитабином и наб-паклитакселом (GnP) считается стандартом лечения пациентов с метастатической ПАПЖ (мПАПЖ). Однако, менее половины пациентов реагируют на такую терапию, остальные (пациенты без ответа, ПБО) продолжают страдать от боли и умирают в течение нескольких недель. Генетические изменения в ПАПЖ плохо объясняют различия между пациентами с ответом на терапию (пациенты с ответом, ПСО) и ПБО, поэтому возникла гипотеза, что на эффективность химиотерапии могут влиять другие факторы, в том числе кишечная микробиота. Соответственно, необходим поиск таких факторов, способных объяснить различия между ПСО и ПБО, для разработки новых концепций будущей терапии. Показано, что кишечная микробиота изменяет ответ на иммунотерапию у пациентов с меланомой, который можно модулировать с помощью диеты [2, 3]. У редких пациентов с длительным периодом выживания и локализованной формой ПАПЖ бактерии могут переходить из кишечника в опухоль и, таким образом, контролировать противоопухолевый иммунный ответ. Пока что большинство пациентов с агрессивной мПАПЖ, устойчивой к иммунотерапии, получают полихимиотерапию, и в настоящее время неясно, влияют ли и каким образом микробиота или особенности питания на ее эффективность [4].
- Кишечная микробиота отличается у пациентов с ПАПЖ, которые отвечают или не отвечают на химиотерапию
- Метаболит триптофана 3-ИУК, продуцируемый микробиотой, содержится в большем количестве у пациентов с ответом
- 3-ИУК повышает эффективность химиотерапии за счет увеличения выработки АФК нейтрофилами и подавления аутофагии в раковых клетках
Что главное в этом исследовании?
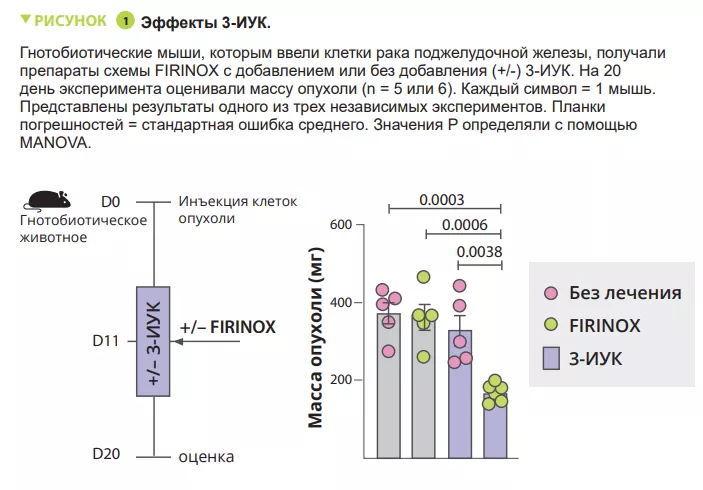
Анализ микробиоты 30 пациентов с мПАПЖ выявил различия между ПСО и ПБО. Перенос микробиоты от ПСО мышам с опухолями поджелудочной железы уменьшал размер опухолей после химиотерапии. Метаболит триптофана 3-ИУК содержался в большем количестве у ПСО и мышей с микробиотой от ПСО, что потенциально могло способствовать лучшему ответу на химиотерапию. Введение 3-ИУК повышало эффективность химиотерапии у мышей (рисунок 1). Результаты анализа иммунных клеток показали увеличение количества CD8+ Т-клеток и уменьшение содержания нейтрофилов у мышей с микробиотой, ассоциирующейся с хорошим ответом на химиотерапию. 3-ИУК влияла на МПО нейтрофилов, тем самым снижая их выживаемость. Комбинация 3-ИУК и химиотерапии снижала количество нейтрофилов и ингибировала рост опухоли, при этом МПО играла решающую р о л ь . Предполагается, что МПО индуцирует выработку АФК, что приводит к гибели клеток во время химиотерапии. Эксперименты in vitro показали, что 3-ИУК повышает уровни АФК. Этот эффект был подтвержден in vivo, где ингибирование АФК N-ацетилцистеином снижало эффективность FIRINOX у мышей с высокими уровнями 3-ИУК. Затем авторы показали, что эффект 3-ИУК был связан со снижением уровня аутофагии. Высокие концентрации 3-ИУК в сыворотке коррелировали со снижением количества нейтрофилов и улучшением выживаемости в двух когортах пациентов
Каковы практические последствия?
Кишечная микробиота влияет на ответ на химиотерапию. Механизмы, изученные в этом исследовании, указывают на роль микробных метаболитов, особенно метаболитов триптофана. Среди них, 3-ИУК является не только прогностическим маркером ответа на химиотерапию при ПАПЖ, но также может выступать в качестве дополнения к основной терапии.
ЗАКЛЮЧЕНИЕ
Кишечная микробиота влияет на ответ на химиотерапию при ПАПЖ. Один из ее метаболитов, 3-ИУК, является предиктором хорошего ответа на химиотерапию и усиливает эффект, индуцируя накопление АФК и уменьшая аутофагию в раковых клетках.
1.Tintelnot J, Xu Y, Lesker TR, et al. Microbiota-derived 3-IAA influences chemotherapy efficacy in pancreatic cancer. Nature 2023 ; 615 : 168-74.
2. Baruch EN, Youngster I, Ben-Betzalel G, et al. Fecal microbiota transplant promotes response in immunotherapy-refractory melanoma patients. Science 2021 ; 371 : 602-9.
3. Spencer CN, McQuade JL, Gopalakrishnan V, et al. Dietary fiber and probiotics influence the gut microbiome and melanoma immunotherapy response. Science 2021 ; 374 : 1632-40.
4. Thomas RM, Jobin, C. Microbiota in pancreatic health and disease: the next frontier in microbiome research. Nat Rev Gastroenterol Hepatol 2020 ; 17 : 53-64.


