El ácido indol-3-acético (3-IAA) derivado de la microbiota intestinal influye en la eficacia de la quimioterapia en el cáncer de páncreas
ARTÍCULO COMENTADO
Por el Prof. Harry Sokol
Gastroenterología y nutrición, Hospital Saint-Antoine, París, Francia
Espacio para el público general
Encuentra aquí tu espacio dedicado
en_sources_title
en_sources_text_start en_sources_text_end
Capítulos
Acerca de este artículo
Autor
Comentario del artículo de Tintelnot et al. Nature 2023 [1]
Se prevé que el adenocarcinoma ductal de páncreas (PDAC) sea el segundo cáncer con mayor mortalidad de aquí a 2040, debido a la alta incidencia de la enfermedad metastática y a las respuestas limitadas al tratamiento. Menos de la mitad de los pacientes responden favorablemente a la quimioterapia, el tratamiento principal del PDAC, y las variaciones genéticas entre los pacientes no son suficientes para explicar las diferencias en las respuestas. Es posible que la alimentación sea uno de los factores ambientales que repercuten en la respuesta a los tratamientos, sin embargo, su papel en el PDAC no está claro. Aquí, mediante la secuenciación metagenómica y un cribado metabolómico, los autores han demostrado que el ácido indol-3-acético (3-IAA), un metabolito del triptófano derivado de la microbiota, se encuentra enriquecido en los pacientes que responden favorablemente al tratamiento. El trasplante de microbiota fecal, las intervenciones nutricionales con triptófano y la administración oral de 3-IAA, aumentan la eficacia de la quimioterapia en modelos murinos humanizados de PDAC. Mediante una combinación de experimentos de pérdida y ganancia de función, los autores han demostrado que la eficacia del 3-IAA y de la quimioterapia requiere la presencia de la mieloperoxidasa (MPO) procedente de los neutrófilos. La MPO oxida el 3-IAA que, en combinación con la quimioterapia, provoca una regulación a la baja de enzimas que degradan las especies reactivas del oxígeno (ROS) como la glutatión peroxidasa 3 y la glutatión peroxidasa 7. Todo ello conduce a una acumulación de ROS y a una regulación a la baja de la autofagia en las células cancerosas, lo que repercute en su capacidad metabólica y, en última instancia, en su proliferación. En humanos, los autores han observado una correlación significativa entre los niveles de 3-IAA y la eficacia del tratamiento en dos cohortes independientes de PDAC. En resumen, los autores han identificado un metabolito derivado de la microbiota que tiene implicaciones clínicas en el tratamiento del PDAC, y han dado una justificación para plantear intervenciones nutricionales durante el tratamiento de los pacientes con cáncer.
¿Qué se sabe ya sobre este tema?
La poliquimioterapia, bien con 5-fluorouracilo (5-FU), irinotecán y oxaliplatino en combinación con ácido folínico (FOLFIRINOX), bien con gemcitabina y nabpaclitaxel (Abraxane), se considera el tratamiento estándar para pacientes con PDAC metastásico (mPDAC). Sin embargo, menos de la mitad de los pacientes responden favorablemente al tratamiento, y los pacientes que no lo hacen (pacientes que no responden, NR) tienen dolor y mueren a las pocas semanas. Las alteraciones genéticas del PDAC no bastan para explicar las diferencias entre los pacientes que responden favorablemente al tratamiento (pacientes que responden, R) y los pacientes NR, lo que convierte a los factores ambientales, incluida la microbiota intestinal, en posibles mediadores de la eficacia de la quimioterapia. Por lo tanto, urge identificar los factores ambientales que podrían explicar las diferencias entre pacientes R y NR, para desarrollar nuevas ideas para futuros tratamientos. Se ha demostrado que la microbiota intestinal interviene en la respuesta a la inmunoterapia en pacientes con melanoma y muchos otros tipos de cáncer, y que puede modularse mediante la alimentación 2, 3. En los poco frecuentes pacientes con PDAC localizado y supervivientes a largo plazo, las bacterias pueden pasar del intestino al tumor y controlar la activación inmunitaria antitumoral. Sin embargo, la mayoría de pacientes con PDAC agresivo y resistente a la inmunoterapia reciben un tratamiento de poliquimioterapia, y aún se desconoce si la microbiota o los hábitos alimenticios influyen en su eficacia y de qué manera 4 .
- La microbiota intestinal es diferente en pacientes con PDAC que responden, o no, a la quimioterapia
- El metabolito del triptófano 3-IAA, producido por la microbiota, está enriquecido en pacientes que responden al tratamiento
- El 3-IAA aumenta la eficacia de la quimioterapia aumentando la producción de ROS mediante los neutrófilos y disminuyendo la autofagia en las células cancerosas
¿Cuáles son los principales resultados aportados por este estudio?
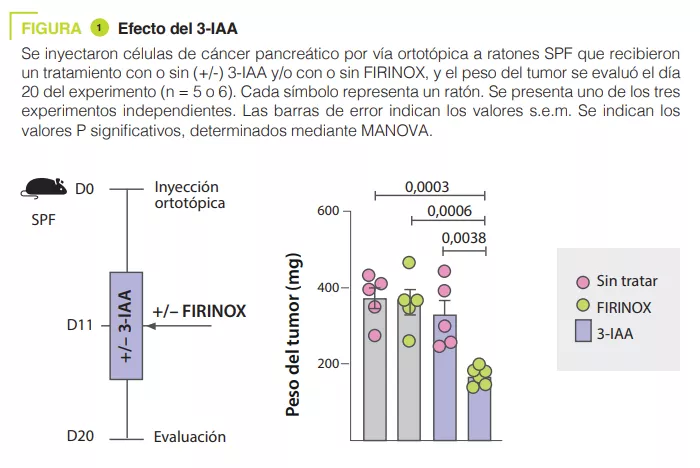
El análisis de la microbiota de 30 pacientes con mPDAC reveló diferencias entre los pacientes R y los NR. La transferencia de microbiota de los R a ratones con tumores pancreáticos permitió reducir el tamaño de los tumores tras la quimioterapia. El metabolito del triptófano 3-IAA se enriqueció en los pacientes R y en los ratones con una microbiota R, posiblemente contribuyendo a la respuesta a la quimioterapia. La administración de 3-IAA mejoró la eficacia de la quimioterapia en los ratones (figura 1). El análisis de las células inmunitarias en los ratones mostró un aumento de linfocitos T CD8+ y una disminución de neutrófilos en ratones con una microbiota asociada a una buena respuesta a la quimioterapia. El 3-IAA afectó a la MPO de los neutrófilos, lo que redujo su supervivencia. La combinación del 3-IAA y de la quimioterapia redujo el número de neutrófilos e inhibió el crecimiento del tumor, en lo que la MPO desempeñó un papel fundamental. Se ha sugerido que la MPO induce la producción de ROS, lo que conduce a la muerte celular durante la quimioterapia. Los experimentos in vitro han demostrado que el 3-IAA aumenta los niveles de ROS. Este efecto se confirmó in vivo, y se observó que la inhibición de las ROS mediante la N-acetilcisteína eliminaba la eficacia de FIRINOX en ratones que presentaban niveles elevados de 3-IAA. A continuación, los autores demostraron que el efecto del 3-IAA estaba relacionado con una regulación a la baja de la autofagia. Por último, las concentraciones séricas elevadas de 3-IAA se correlacionaban con un descenso del recuento de neutrófilos y una mejora de la supervivencia en dos cohortes de pacientes humanos.
¿Cuáles son las consecuencias en la práctica?
La microbiota intestinal repercute en la respuesta a la quimioterapia. Los mecanismos implicados en este estudio demuestran el papel de los metabolitos microbianos y, en particular, de los metabolitos del triptófano. Entre ellos, el 3-IAA no solo es un marcador predictivo de la respuesta a la quimioterapia en el PDAC, sino que también podría representar una molécula terapéutica adyuvante.
CONCLUSIÓN
La microbiota intestinal repercute en la respuesta a la quimioterapia en el PDAC. Uno de sus metabolitos, el 3-IAA, es predictor de una buena respuesta a la quimioterapia y aumenta su efecto al provocar una acumulación de ROS y una reducción de la autofagia de las células cancerosas.
1.Tintelnot J, Xu Y, Lesker TR, et al. Microbiota-derived 3-IAA influences chemotherapy efficacy in pancreatic cancer. Nature 2023 ; 615 : 168-74.
2. Baruch EN, Youngster I, Ben-Betzalel G, et al. Fecal microbiota transplant promotes response in immunotherapy-refractory melanoma patients. Science 2021 ; 371 : 602-9.
3. Spencer CN, McQuade JL, Gopalakrishnan V, et al. Dietary fiber and probiotics influence the gut microbiome and melanoma immunotherapy response. Science 2021 ; 374 : 1632-40.
4. Thomas RM, Jobin, C. Microbiota in pancreatic health and disease: the next frontier in microbiome research. Nat Rev Gastroenterol Hepatol 2020 ; 17 : 53-64.


