La colestasis altera el desarrollo de la microbiota intestinal y la actividad de la hidrolasa de los ácidos biliares en recién nacidos prematuros
ARTÍCULO COMENTADO - Niño
Por el Prof. Emmanuel Mas
Gastroenterología y nutrición, Hospital de Niños, Toulouse, Francia
Espacio para el público general
Encuentra aquí tu espacio dedicado
en_sources_title
en_sources_text_start en_sources_text_end
Capítulos

Acerca de este artículo
Comentario sobre el artículo original de Lynch LE et al. (Gut Microbes) [1]
La colestasis es un trastorno del flujo de la bilis del hígado al intestino. En neonatos, la colestasis provoca una deficiencia en el crecimiento y puede evolucionar a una insuficiencia hepática y la muerte. El flujo biliar normal necesita un eje hígado-intestino-microbiota intacto, en el que los ácidos biliares primarios derivados del hígado se transforman en ácidos biliares secundarios. Las enzimas microbianas (hidrolasa de los ácidos biliares [BSH]) son responsables de la primera etapa, que consiste en desconjugar los ácidos biliares primarios conjugados con glicina y taurina. En los neonatos, la colestasis suele tratarse con ácido ursodesoxicólico (UDCA), un potente ácido biliar colerético, a pesar de que no se comprenden bien las interacciones entre el UDCA, las bacterias intestinales y los otros ácidos biliares. Este estudio, basado en 124 muestras de heces procedentes de 24 recién nacidos, revela nuevas asociaciones que relacionan los ácidos biliares isoméricos y la actividad de la BSH con las trayectorias del crecimiento neonatal. Estos datos ponen de relieve el hecho de que la desconjugación de los ácidos biliares es una función microbiana fundamental, adquirida al principio del desarrollo neonatal y alterada por la colestasis.
¿Qué se sabe ya sobre este tema?
Los neonatos prematuros, nacidos antes de las 37 semanas de amenorrea (SA), presentan un mayor riesgo de padecer colestasis. La colestasis, que se define por una disminución del flujo biliar, se ve favorecida por distintos factores de riesgo como la prematuridad, un bajo peso al nacer y la nutrición parenteral.
A falta de una causa, se habla de colestasis neonatal transitoria. Para mejorar la colestasis, se suele iniciar un tratamiento con ácido ursodesoxicólico (UDCA).
Los ácidos biliares son necesarios para la absorción de lípidos y vitaminas liposolubles. Durante una colestasis, se produce una disminución de la cantidad de ácidos biliares en el intestino, pero también una modificación de las proporciones de los distintos ácidos biliares.
Los ácidos biliares primarios se producen a partir del colesterol y se conjugan en el hígado. Sus interacciones con la microbiota intestinal son importantes, y dan lugar a la formación de ácidos biliares secundarios, mediante la interacción de una enzima microbiana, la hidrolasa de ácidos biliares (BSH).
Los ácidos biliares y la microbiota intestinal repercuten en el crecimiento y el desarrollo de los bebés prematuros. Los autores han querido estudiar el impacto de la colestasis en el desarrollo de la microbiota intestinal en bebés extremadamente prematuros y en la desconjugación de los ácidos biliares.
¿Cuáles son los principales resultados aportados por este estudio?
Los autores incluyeron a 24 recién nacidos prematuros, 12 con colestasis y 12 testigos, nacidos en la 27,2 ± 1,8 SA, con un peso medio al nacer de 946 ± 249,6 g. El pico medio de bilirrubina conjugada fue de 7,0 mg/dl. No había diferencias entre los dos grupos en cuanto al entorno intrauterino, el tipo de parto y el uso de antibióticos a lo largo del tiempo.
Se recogieron muestras de heces desde el nacimiento hasta las seis semanas de vida. La secuenciación de las muestras (secuenciación indiscriminada o shotgun) mostró que, en los testigos, la diversidad alfa aumentaba durante el primer mes de vida. En cuanto a los filos, Proteobacteria y Firmicutes fueron los más abundantes; en cuanto a los géneros, Staphylococcus fue el más abundante al nacer para luego disminuir, mientras que la abundancia de Klebsiella aumentaba progresivamente (figura 1). Clostridium perfringens fue la especie cuya abundancia relativa aumentaba más con el paso del tiempo, que se definió por la edad postmenstrual (PMA, suma de la edad al término del parto (SA) y de la edad postnatal) (p = 0,01). El análisis metagenómico demostró que la vía metabólica más enriquecida en las heces maduras (32-40 semanas PMA) en comparación con las menos maduras (25- 28 semanas PMA) era la de la biosíntesis de ácidos biliares secundarios.
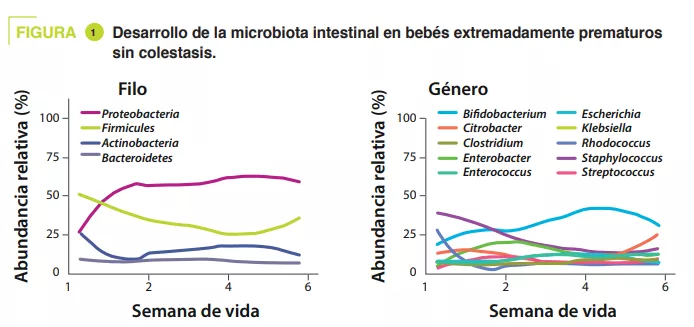
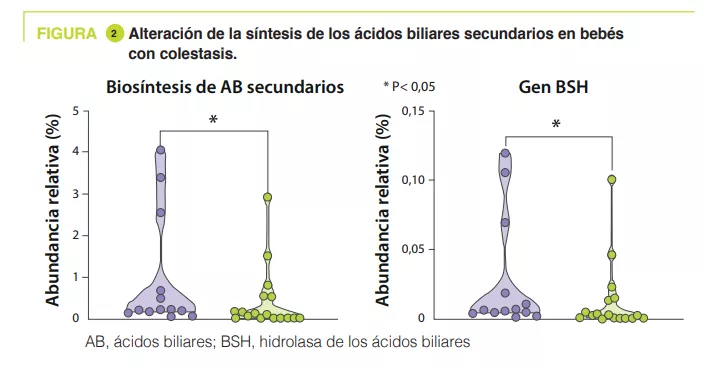
En los testigos, el análisis de componentes principales demostró que el principal factor que influía en la composición de la microbiota intestinal es la PMA, mientras que no afectaba a los prematuros con colestasis. La vía de biosíntesis de ácidos biliares secundarios era la más enriquecida en las heces de los testigos frente a las de los colestásicos a las 32-40 PMA (p = 0,04). Del mismo modo, los autores observaron una disminución del 55 % de la abundancia relativa del gen BSH (p = 0,04) y de Clostridium perfringens (p = 0,0008) en los neonatos con colestasis (figura 2).
El perfil de los ácidos biliares fecales medido por espectrometría de masas mostró que la proporción de ácidos biliares no conjugados aumentaba de un 4 % a las 25-28 semanas PMA hasta un 98 % a las 32-40 semanas PMA en los testigos, pero solo hasta 46 % en los neonatos con colestasis. Cabe señalar que ciertos isómeros podrían tener un valor predictivo, porque aumentaban antes del inicio de la colestasis. El UDCA, utilizado en cinco de los 12 neonatos prematuros, se encuentra en sus heces con una concentración 522 veces superior a los otros 7 no tratados.
El UDCA modificó la microbiota intestinal con un aumento relativo de Firmicutes y una disminución de Proteobacteria (p <0,05), y en cuanto a las especies, con un enriquecimiento de Clostridium perfringens.
Por último, los bebés prematuros con una abundancia fecal del gen BSH > 0,005 % a las 32-40 semanas PMA presentaron velocidades de crecimiento estatural y ponderal incrementadas en un factor de 1,2 en comparación con los que presentaban una abundancia 30 % se relacionó con un aumento medio de las velocidades de crecimiento de la altura (14 %), del peso (18 %) y del perímetro cefálico (15,8 %) (p < 0,05).
¿Cuáles son las consecuencias en la práctica?
Este estudio permite comprender mejor los mecanismos fisiopatológicos implicados en la desregulación del eje hígado-intestino-microbiota intestinal durante la colestasis. Es posible que esto permita plantear una corrección del ciclo entero-hepático con ayuda de ciertos probióticos u otros medicamentos (basados en la actividad de la BSH) u otros medicamentos.
CONCLUSIÓN
En los recién nacidos extremadamente prematuros, la colestasis altera el desarrollo de la microbiota intestinal, reduciendo la adquisición de Clostridium perfringens y la capacidad de sintetizar ácidos biliares secundarios. Por el contrario, un aumento de ciertos ácidos biliares, relacionado con la actividad de la BSH, se asocia a un mejor crecimiento neonatal.

