L'intestin du bébé au coeur de l'immunité
Par le Dr Travis J. De Wolfe
Section grand public
Retrouvez ici votre espace dédié
en_sources_title
en_sources_text_start en_sources_text_end
Chapitres
A propos de cet article
Auteurs
Sommaire
Chapitres
Le développement de barrières immunitaires innées
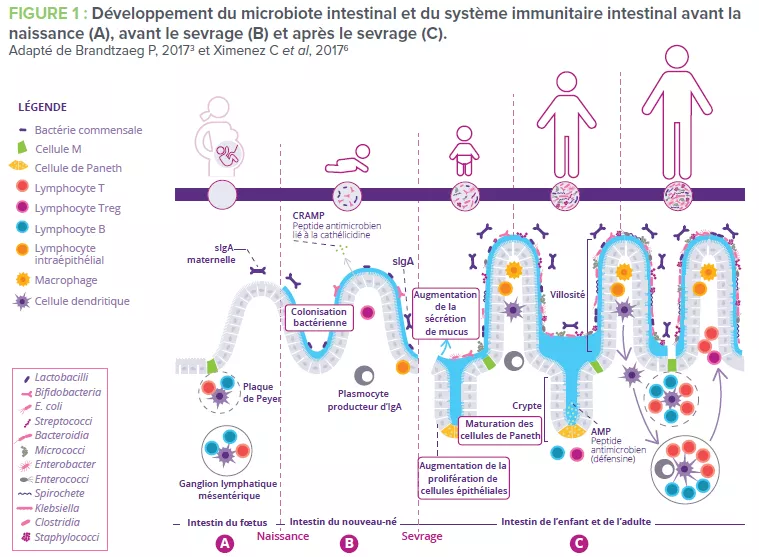
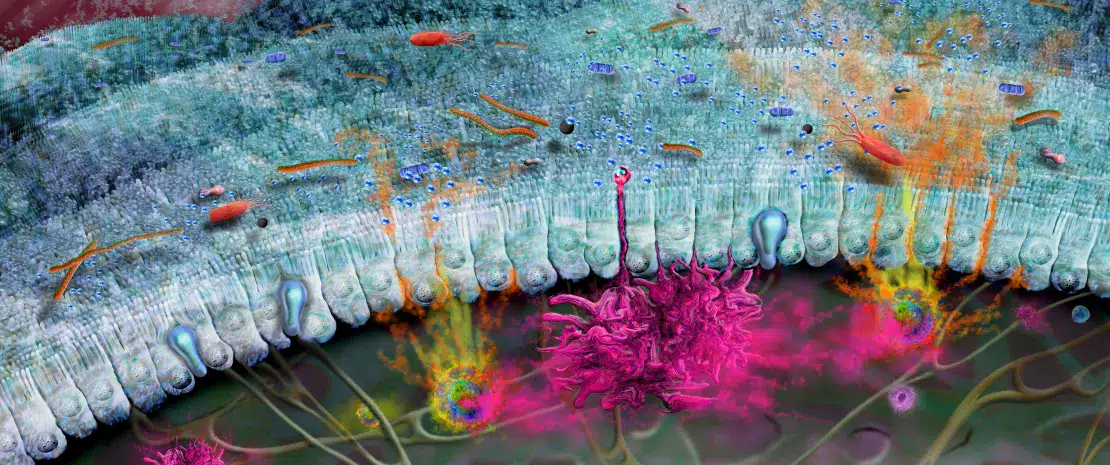
Le développement du système immunitaire intestinal commence avant la naissance et se poursuit jusqu’au sevrage du nourrisson. Certaines structures lymphoïdes immatures telles que les plaques de Peyer et les ganglions lymphatiques mésentériques sont conçues in utero. (Fig 1A). Afin de compenser le fait que ces structures ne sont pas encore totalement fonctionnelles, des peptides antimicrobiens (AMP) sont produits par l’épithélium intestinal et servent de barrière défensive en réponse aux premiers colonisateurs bactériens (Fig 1B)1. Le mucus produit par les cellules caliciformes et sécrété à la surface apicale du tube digestif constitue une autre barrière importante. Ensemble, ces barrières immunitaires innées jouent un rôle décisif pour limiter le contact direct entre le microbiote intestinal et les cellules épithéliales de l’hôte, notamment au cours de l’établissement du microbiote dans l’intestin du bébé.
80% Au moins 80 % des cellules du corps humain productrices d’Ig se trouvent dans l’intestin
Le système immunitaire adaptatif du nouveau-né joue un rôle clef au cours du développement
Des immunoglobulines A (IgA) possédant différents degrés d’affinité envers les micro-organismes du microbiote et les antigènes alimentaires spécifiques ingérés par le nouveau-né sont produits. L’IgA sécrétée se fixe à ces cibles dans le lumen intestinal et limite leur capacité à adhérer à l’épithélium intestinal ou à le pénétrer (Fig 1B)2. De la même façon, au moment du sevrage, le microbiote intestinal du nouveau-né se diversifie et va répondre au changement d’alimentation et au développement des cryptes et des villosités intestinales. Cette évolution exige une plus grande protection de la barrière épithéliale grâce à la maturation des structures lymphoïdes locales. Les cellules de Paneth activées commencent à produire des protéines de défense de l’hôte (défensines) à la base des petites cryptes intestinales, permettant ainsi à d’autres cellules épithéliales de cesser de produire des AMP et d’effectuer leur transition. Enfin, la prolifération de cellules épithéliales augmente parallèlement à la sécrétion de mucus (Fig 1C).
L'importance de l'homéostasie intestinale
Au moins 80 % des cellules du corps humain productrices d’Ig se trouvent dans l’intestin3 : c’est donc l’organe effecteur le plus important de l’immunité humorale. Des cellules épithéliales spécialisées dans l’échantillonnage des antigènes (cellules M) exercent une fonction de garde-barrière en facilitant le transport des antigènes – provenant des bactéries commensales, de l’alimentation ou de pathogènes – depuis le lumen intestinal jusqu’aux cellules lymphoïdes sous-jacentes. Ces antigènes sont ensuite digérés par les cellules dendritiques avant d’être présentés au système immunitaire adaptatif.
Conjointement, les différents composants de l’immunité intestinale favorisent l’homéostasie à l’aide de deux stratégies anti-inflammatoires (Fig 1C):
1) L’exclusion immunitaire des antigènes étrangers empêche le microbiote intestinal de coloniser ou de pénétrer la muqueuse intestinale ou en tout cas limite cette colonisation. C’est la sIgA qui remplit cette fonction3.
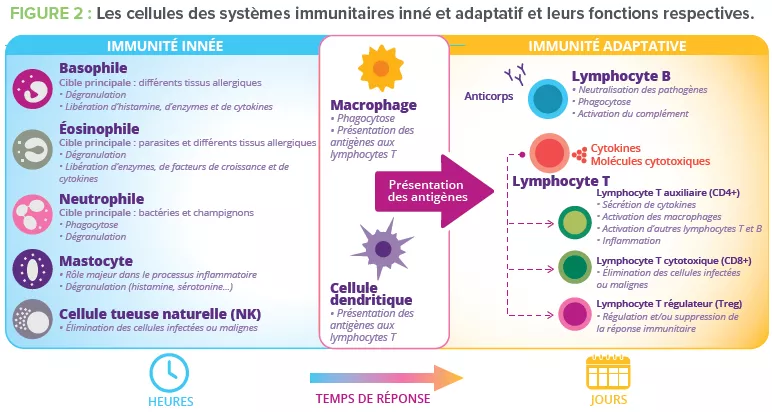
2) La tolérance orale limite les réponses immunitaires locales et périphériques aux antigènes inoffensifs qui entrent en contact avec la barrière épithéliale4. Ce mécanisme est dépendant des lymphocytes Treg qui exercent des fonctions de régulation (Fig 2)3.
Lorsque ces stratégies fonctionnent correctement, la régulation du système immunitaire ainsi que les actions du microbiote commensal favorisant le développement et l’entraînement de ce système donnent naissance à une relation hôte-commensal durable et en équilibre qui a des répercussions sur la santé humaine à long terme5.
Au-delà des cellules immunitaires : l’importance de la barrière constituée par le mucus intestinal
Par le Dr. Larissa Celiberto
L’intestin est tapissé d’une unique couche de cellules appelée épithélium intestinal, sur laquelle repose une couche de mucus dense (Fig 1). Ensemble, ces barrières empêchent les microbes de sortir du lumen intestinal et évitent l’activation inutile du système immunitaire par le microbiote3. Le mucus intestinal produit et libère de la mucine 2 (MUC2), une glycoprotéine qui donne sa structure au mucus. Des études récentes montrent que le microbiote intestinal exerce une influence déterminante sur la maturation et le fonctionnement de la couche de mucus, tandis que les types de sucres présents sur la MUC2 peuvent également affecter la capacité des bactéries à s’y fixer ou à utiliser celle-ci ainsi que ses chaînes de glucides comme nutriments7. En particulier, l’altération ou le dysfonctionnement de la barrière de mucus peut donner lieu à la pénétration ou au passage de bactéries potentiellement nocives en provenance du lumen intestinal (par exemple, en cas d’intestin perméable), ce qui peut déboucher sur une infection et une inflammation systémiques8. Par ailleurs, un défaut de la couche de mucus et une dysbiose intestinale9 ont été observés dans plusieurs maladies (dont les maladies inflammatoires chroniques de l’intestin (MICI)10,11, le diabète12…), ce qui souligne l’importance de cette barrière protectrice pour la santé humaine.
3 Brandtzaeg P. (2017) Role of the Intestinal Immune System in Health. In: Baumgart D. (eds) Crohn's Disease and Ulcerative Colitis. Springer, Cham.
4 Commins SP. Mechanisms of Oral Tolerance. Pediatr Clin North Am. 2015 Dec;62(6):1523-9.