El intestino del bebé en el centro de la inmunidad
Por el Dr. Travis J. De Wolfe
Espacio para el público general
Encuentra aquí tu espacio dedicado
en_sources_title
en_sources_text_start en_sources_text_end
Capítulos
Acerca de este artículo
Autores
Índice
Índice
Desarrollo de barreras inmunes innatas
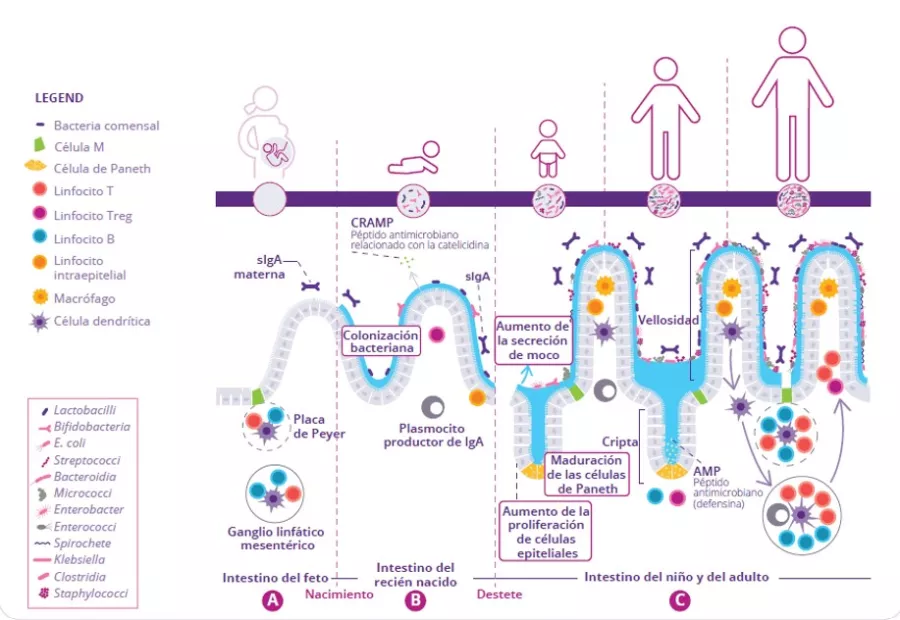
El desarrollo del sistema inmunitario intestinal comienza antes del nacimiento y continúa hasta el destete. In utero se generan distintas estructuras linfoides inmaduras como las placas de Payer y los ganglios linfáticos mesentéricos (Fig 1A).
Para compensar el hecho de que estas estructuras no son perfectamente funcionales hasta una etapa más avanzada del desarrollo, el epitelio intestinal produce péptidos antimicrobianos (AMP) que cumplen una función de barrera defensiva frente a los primeros colonizadores bacterianos (Fig 1B).1 El moco producido por las células caliciformes y secretado en la superficie apical del tubo digestivo constituye otra barrera importante. Conjuntamente, estas barreras inmunes innatas desempeñan una función crítica al limitar el contacto directo entre la microbiota intestinal y las células epiteliales del huésped, sobre todo durante el proceso de establecimiento de la microbiota intestinal del bebé.
80% At least 80% of the body Ig-producing cells are located in the gut.
El sistema inmunitario adaptativo del recien nacido tambien es critico durante el desarrollo
El sistema inmunitario adaptativo produce inmunoglobulina A (IgA) que tiene distintas afinidades por los componentes de la microbiota y los antígenos específicos contenidos en los alimentos que ingiere el recién nacido. La IgA secretada se une a estas dianas en la luz intestinal y limita su capacidad de penetración y adherencia al epitelio intestinal (Fig 1B).2 Después del destete, la microbiota intestinal se vuelve cada vez más diversificada y concentrada en respuesta al cambio de alimentación y al desarrollo de la arquitectura cripta-vellosidades. La protección adicional de la barrera epitelial que requiere este proceso se consigue gracias a la maduración de las estructuras linfoides locales. Las células de Paneth activadas empiezan a producir proteínas de defensa del huésped (defensinas) en la base de las pequeñas criptas intestinales, permitiendo la transición de otras células epiteliales, que dejan de producir péptidos antimicrobianos. Por último, la proliferación de células epiteliales aumenta en paralelo con el aumento de la secreción de moco (Fig 1C).
FIGURA 1: Desarrollo de la microbiota intestinal y del sistema inmunitario intestinal antes del nacimiento (A), antes del destete (B) y después del destete (C).
Adaptado de Brandtzaeg P, 20173 and Ximenez C et al, 20176
Importancia de la homeostasis intestinal
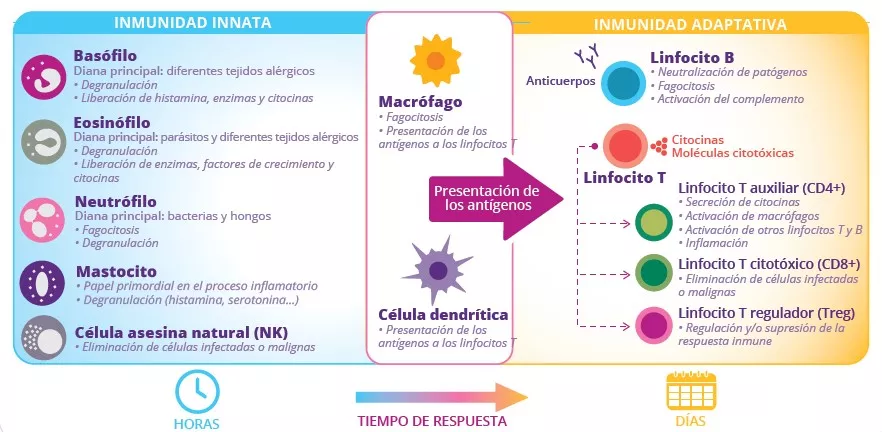
Dado que al menos el 80 % de las células productoras de Ig del cuerpo se sitúan en el intestino,3 este es el principal órgano efector de la inmunidad humoral. Las células M (células epiteliales especializadas en la captación de antígenos) cumplen una función de filtración y facilitan el transporte de antígenos –procedentes de bacterias comensales, de la alimentación o de patógenos– desde la luz intestinal a las células linfoides subyacentes. Las células dendríticas (CD) digieren estos antígenos y los presentan al sistema inmunitario adaptativo.
Juntos, los diferentes componentes de la inmunidad intestinal promueven la homeostasis mediante dos estrategias antiinflamatorias (Fig 1C):
1) La exclusión inmune de anticuerpos extraños limita o impide la penetración o colonización de la mucosa intestinal por parte de la microbiota intestinal. La sIgA es la que cumple esta función.3
2) La tolerancia oral limita las respuestas inmunes locales y periféricas a los antígenos inocuos que entran en contacto con la barrera epitelial.4 Esta estrategia reposa en los linfocitos T reguladores (Treg) (Fig 2).3
Cuando estas estrategias funcionan correctamente, la regulación del sistema inmunitario y los efectos de la microbiota comensal en el desarrollo y el entrenamiento de este sistema conducen al establecimiento de una relación duradera y homeostática entre el huésped y la microbiota comensal que tiene implicaciones a largo plazo para la salud humana.5
Más allá de las células inmunes: la importancia de la barrera formada por el moco intestinal
Por la Dra. Larissa Celiberto
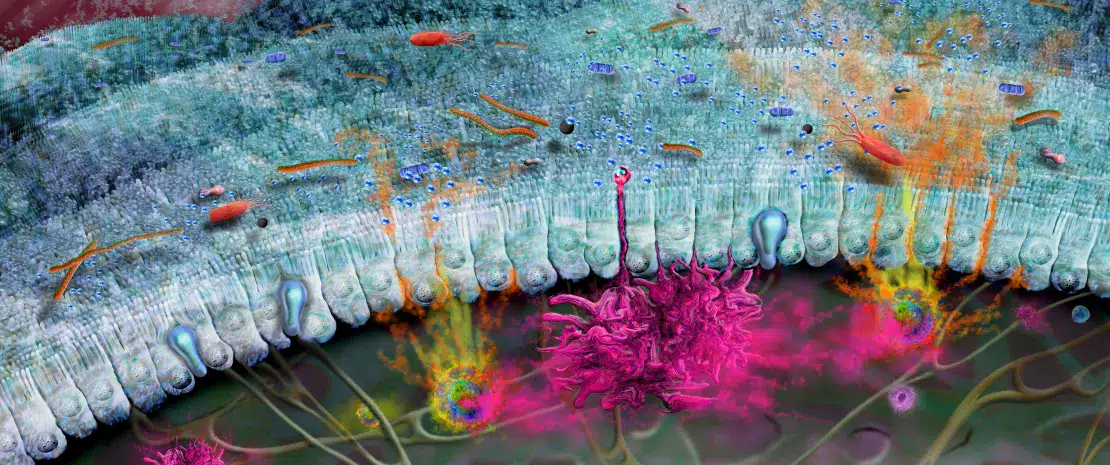
El intestino está tapizado por una única capa de células llamada “epitelio intestinal” sobre la cual reposa una densa capa de moco (Fig 1). Conjuntamente, estas barreras impiden que los microbios escapen de la luz intestinal y que la microbiota active inútilmente el sistema inmunitario subyacente.3 El moco intestinal produce y libera mucina 2 (MUC2), una glucoproteína que da estructura al moco. Estudios recientes demostraron que la maduración y el funcionamiento de la capa de moco dependen estrechamente de la microbiota intestinal, mientras que los tipos de azúcares presentes en la MUC2 también pueden determinar qué bacterias son capaces de unirse a ella o de utilizar la MUC2 y sus cadenas de azúcares como nutrientes.7 En particular, una ruptura o disfunción de la barrera de moco puede provocar un aumento de la penetración de bacterias potencialmente dañinas o su salida de la luz intestinal (p.ej., intestino permeable), desencadenando inflamación e infección sistémicas.8 Además, se han observado defectos en la capa de moco y una consiguiente disbiosis intestinal 9 en varias enfermedades (como la enfermedad inflamatoria intestinal (EII),10,11 la diabetes, etc.12), lo cual subraya la importancia de esta barrera protectora para la salud humana.
FIGURA 2: Las células de los sistemas inmunitarios innato y adaptativo y sus respectivas
3 Brandtzaeg P. (2017) Role of the Intestinal Immune System in Health. In: Baumgart D. (eds) Crohn's Disease and Ulcerative Colitis. Springer, Cham.
4 Commins SP. Mechanisms of Oral Tolerance. Pediatr Clin North Am. 2015 Dec;62(6):1523-9.