Papel de la microbiota intestinal en la regulación inmunitaria
Al participar en la regulación de las respuestas inmunitarias innata y adaptativa, la microbiota intestinal se ha convertido en una de las piezas clave de los mecanismos de defensa, especialmente gracias a la presencia de bacterias específicas como las bacterias filamentosas segmentadas (BFS)3. Si bien la microbiota es capaz de actuar sobre la inmunidad, puede a su vez ser controlada por el mismo sistema inmunitario en cuanto a composición y diversidad se refiere.
Espacio para el público general
Encuentra aquí tu espacio dedicado
en_sources_title
en_sources_text_start en_sources_text_end
Capítulos
Acerca de este artículo
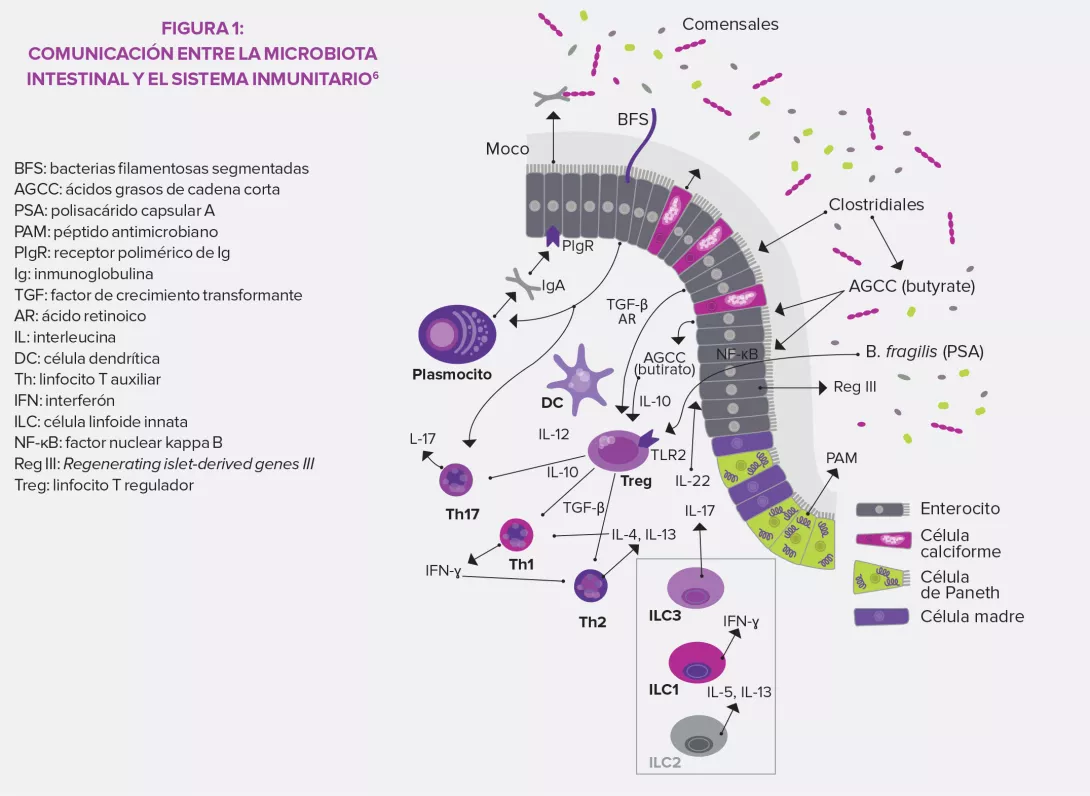
Entre las células especializadas de la inmunidad innata, se encuentran las células linfoides innatas (ILC), una población de linfocitos que no posee receptores de antígeno específico6. Recientemente identificadas, se dividen en tres categorías según el tipo de citocinas que secretan: ILC1 similares a los linfocitos T auxiliares (T helper) Th1 y que producen interferón gamma (IFN-γ), ILC2 similares a los Th2 (IL-5, IL-6, IL-13) e ILC3 similares a los Th17 (IL-17, IL-22). Estudios sobre la microbiota y las ILC, actualmente en pleno desarrollo, muestran que la microbiota sería necesaria para el desarrollo y funciones de las ILC, en particular las del grupo 3 (ILC3), que son la principal fuente intestinal de IL-22, una citocina básica para la producción de proteínas antimicrobianas6
ASPECTOS CLAVE
BACTERIAS FILAMENTOSAS SEGMENTADAS (BFS)
- Bacterias comensales (familia Clostridiales) identificadas previamente en animales vertebrados y detectadas en el hombre gracias al uso de técnicas moleculares.3,5
- Necesarias para la maduración de la barrera inmune intestinal y pulmonar. Además, inducen la producción de IgA y la activación de LT proinflamatorios y reguladores.3,5
- Tienen un efecto protector en la diabetes tipo I (ratones diabéticos no obesos [NOD, Non Obese Diabetic], en la neumopatía por Staphyloccocus aureus resistente a meticilina
(SARM) y en algunas infecciones bacterianas (por Citrobacter rodentium) y parasitarias (por Entamoeba histolytica).3,5
- Pueden tener efectos negativos al favorecer el desarrollo de enfermedades autoinmunes en modelos de artritis y encefalopatía autoinmune3,5
INMUNIDAD ADAPTATIVA
La microbiota intestinal es además fundamental para la activación de la respuesta adaptativa. A nivel de los linfocitos T (LT), induce la maduración de LT vírgenes que se diferencian en Th17, productores de IL-17 que estimulan la producción de péptidos antimicrobianos por el epitelio intestinal. También posibilita la síntesis de algunos LT CD4+ reguladores (Treg) que ejercen un efecto antiinflamatorio. Por último, contribuye al desarrollo de tejidos linfoides secundarios del intestino dondese almacenan los LT de reserva. En cuanto a los linfocitos B (LB), la microbiota intestinal asegura, mediante la acción de la IL-17, el paso de las IgA secretoras (producidas por los LB) a través de la mucosa intestinal con el objetivo de alcanzar la luz intestinal y neutralizar toxinas y bacterias nocivas. La intensa respuesta de tipo IgA junto a la respuesta proinflamatoria (Th17) y antiinflamatoria (Treg) de los LT crean un estado de inflamación fisiológico controlado por la microbiota intestinal3,5.
6 Marteau P, Dore J. Gut microbiota: a full-fledged organ, Chapter 8 «Gut microbiota and immune system». John Libbey Eurotext. 2017.





