Rôle du microbiote intestinal dans la régulation immunitaire
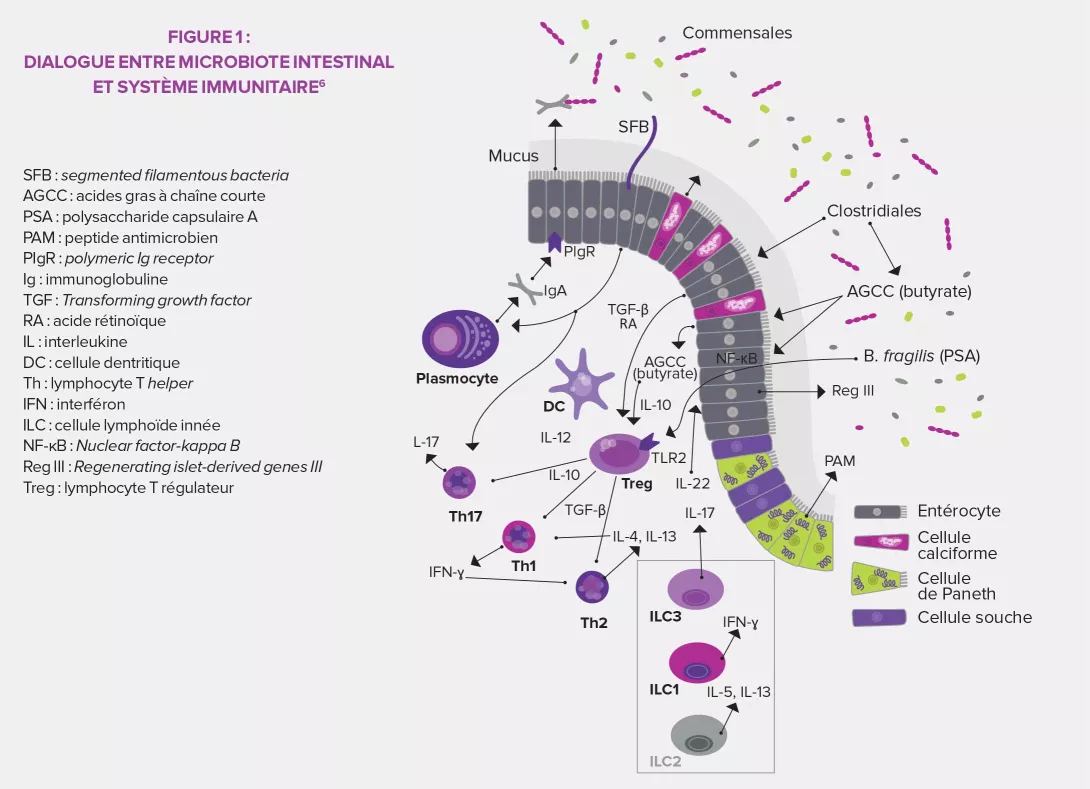
En participant à la régulation des réponses immunitaires innée et adaptative, le microbiote intestinal devient l’une des clés de voûte des mécanismes de défense, particulièrement grâce à la présence de bactéries spécifiques : les bactéries segmentées filamenteuses (SFB, pour Segmented Filamentous Bacteria)3. Capable d’exercer une action sur l’immunité, le microbiote peut à son tour être contrôlé par ce même système immunitaire au niveau de sa composition et de sa diversité.
Section grand public
Retrouvez ici votre espace dédié
en_sources_title
en_sources_text_start en_sources_text_end
Chapitres
A propos de cet article
Entre autres cellules spécialisées de l’immunité innée, les cellules lymphoïdes innées (ILC) sont une population de lymphocytes qui ne possèdent pas de récepteurs d’antigène spécifique6. Récemment identifiées, elles sont groupées en trois catégories en fonction du type de cytokines sécrétées : ILC1 produisant de l’interféron gamma (IFN-γ) et proches des lymphocytes T auxiliaires (T helper) Th1, ILC2 proches des Th2 (IL5, IL-6, IL-13) et ILC3 proches des Th17 (IL-17, IL-22). Les études sur le microbiote et les ILC, actuellement en plein développement, montrent également que le microbiote serait nécessaire au développement et aux fonctions des ILC, en particulier du groupe 3. Ces ILC3 sont la principale source intestinale d’IL-22, une cytokine centrale pour la production de protéines antimicrobiennes6
POINTS-CLÉS
LES BACTÉRIES SEGMENTÉES FILAMENTEUSES (SFB)
- Bactéries commensales (famille des Clostridiales) identifiées préalablement chez les animaux vertébrés et détectées chez l’homme grâce aux outils moléculaires
- Nécessaires à la maturation de la barrière immune intestinale et pulmonaire et induisent la production d’IgA et l’activation de LT pro-inflammatoires et régulateurs
- Effet protecteur dans le diabète de type I (souris Non Obese Diabetic), les pneumopathies à Staphyloccocus aureus résistant à la méthicilline (SARM), contre certaines infections bactériennes (à Citrobacter rodentium) et parasitaires (à Entamoaba histolytica)
- Peuvent exercer des effets négatifs en favorisant le développement de pathologies auto-immunes dans des modèles d’arthrite et d’encéphalite autoimmune
IMMUNITÉ ADAPTATIVE
Le microbiote intestinal est également au cœur de l'activation de la réponse adaptative. Au niveau des lymphocytes T (LT), il induit la maturation de LT naïfs en Th17 producteurs d'IL-17 qui stimulent la production de peptides antimicrobiens par l'épithélium intestinal. Il permet aussi la synthèse de certains LT CD4+ régulateurs (les Treg) qui ont une action anti-inflammatoire. Enfin, il contribue au développement de tissus lymphoïdes secondaires de l'intestin où sont stockés les LT de réserve. Concernant les lymphocytes B (LB), le microbiote intestinal assure, par la voie de l'IL-17, le passage des IgA sécrétoires (produits par les LB) à travers la muqueuse intestinale pour rejoindre la lumière et y neutraliser les toxines et bactéries nocives. Entre réponses IgA fortes et réponses des LT à la fois pro-inflammatoires (Th17) et anti-inflammatoires (Treg), s'établit ainsi un état d’inflammation physiologique sous l'influence du microbiote intestinal3,5.
6 Marteau P, Dore J. Gut microbiota: a full-fledged organ, Chapter 8 «Gut microbiota and immune system». John Libbey Eurotext. 2017.





