Le microbiote Intestinal, premier rempart contre les agressions
On savait le système immunitaire naïf dans les tout premiers instants de la vie et en évolution constante au gré des contacts antigéniques ultérieurs. On lui découvre aujourd’hui un adjuvant dans sa structuration : le microbiote intestinal, présent dès les prémisses de sa formation et qui ne la quitte plus ensuite. Un équilibre reposant sur des interactions complexes s’établit ainsi de manière précoce et permet la cohabitation des acteurs.
Section grand public
Retrouvez ici votre espace dédié
en_sources_title
en_sources_text_start en_sources_text_end
Chapitres
A propos de cet article
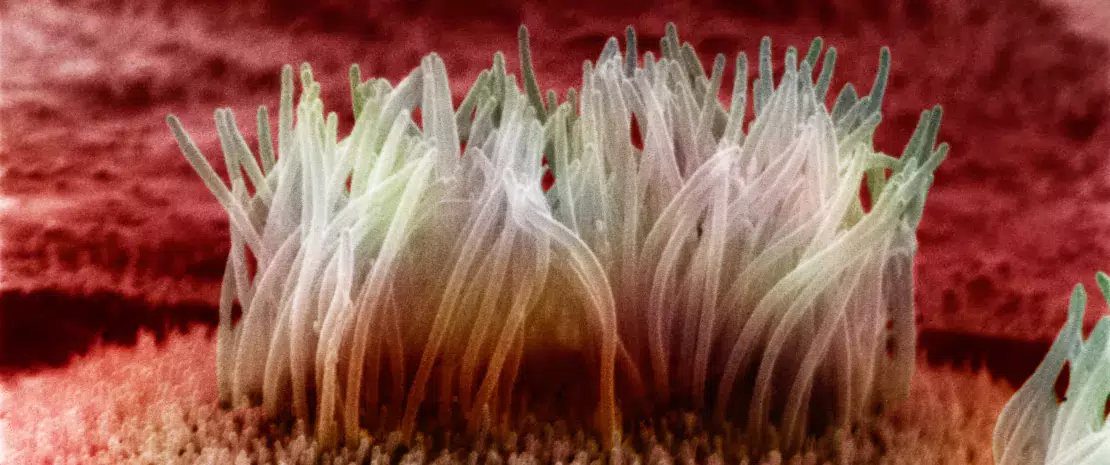
Siège de l’interface entre le système immunitaire et le microbiote intestinal, la barrière épithéliale est un lieu-clé où s’établit un véritable dialogue entre l’immunité de l’hôte et ses bactéries.
Avec ses 1014 micro-organismes, le microbiote intestinal aurait tôt fait d’envahir son hôte si une coexistence pacifique ne s’était pas établie entre eux au fil de l’évolution. La barrière intestinale est la première garante de cette cohabitation : les cellules épithéliales de l’intestin sécrètent un mucus épais dans lequel les bactéries de la lumière intestinale puisent des ressources nutritives, sans toutefois pouvoir la franchir dans des conditions non-pathologiques.
UN ÉQUILIBRE MULTIFACTORIEL
Les échanges constants entre hôte et microbiote se révèlent fondamentaux pour l’équilibre physiologique de l’immunité intestinale. Dans les cryptes villositaires de l’intestin grêle, la fixation de bactéries sur certains récepteurs (NOD21 ) des cellules de Paneth2 provoque la production de peptides antimicrobiens comme le lysozyme. L’activation des Toll-like receptors (TLR) par des bactéries au niveau de la membrane des cellules épithéliales et lymphoïdes déclenche le recrutement de phagocytes, de lymphocytes et de cellules dendritiques (acteurs de l’immunité innée) situés dans la couche sous-épithéliale. Ce déclenchement s’opère via la voie de signalisation NF-kB, elle-même régulée par les acides gras à chaîne courte (AGCC) produits par certaines souches bactériennes et par la production de chimiokines et de cytokines3 . Un équilibre règne ainsi entre intégrité de la muqueuse intestinale, activation bactérienne des défenses immunitaires et régulation des réponses engagées par le microbiote lui-même. La perturbation d’un seul de ces maillons entraîne des processus inflammatoires chroniques.

MODE D’ACCOUCHEMENT ET ALIMENTATION INFANTILE, DEUX FACTEURS CAPITAUX
Les nourrissons nés par césarienne ont une proportion plus élevée de lymphocytes B que ceux nés par voie basse, signe d’une immunité plus active dès la période néo-natale4 . Le lait maternel favorise également le développement des défenses naturelles et la maturation intestinale par sa composition et ses apports : lysozyme ; IgA, des anticorps situés à la surface de la muqueuse intestinale ; caséine kappa (dont les produits de dégradation peuvent entrer en compétition avec des pathogènes au niveau des récepteurs des cellules épithéliales intestinales chez les enfants allaités) ; lactoferrine, dont le produit de dégradation – la lactoferricine – est un peptide antimicrobien à action bactériostatique et bactéricide. Il contient également environ 109 bactéries/L ainsi que des fructanes, des prébiotiques qui favorisent la croissance des bifidobactéries et des lactobacilles. Quant aux laits maternisés, ils promeuvent davantage la multiplication d’entérocoques et d’entérobactéries5.
1 Nucleotide-binding Oligomerization Domain 2
2 Cellules épithéliales situées au fond des cryptes villositaires de l’intestin grêle et impliquées dans la défense immunitaire du système digestif
3 Gaboriau-Routhiau V, Cerf-Bensussan N. Microbiote intestinal et développement du système immunitaire. Médecine/Science. 2016
4 Clemente JC, Ursell LK, Parfrey LW, et al. The impact of the gut microbiota on human health: an integrative view. Cell. 2012;148(6):1258-1270.
5 Lazar V, Ditu LM, Pircalabioru GG, et al. Aspects of Gut Microbiota and Immune System Interactions in Infectious Diseases, Immunopathology, and Cancer. Front Immunol. 2018;9:1830.





