Микробиота кишечника – первый бастион на пути агрессоров
Как известно, иммунная система в раннем возрасте является «необученной» и постоянно развивается, реагируя на последующие контакты с антигенами. Теперь мы узнали, что ее структурному становлению помогает кишечная микробиота, которая присутствует с самого начала ее развития и никогда не исчезает. Этот баланс основан на сложных взаимодействиях. Он развивается на раннем этапе и позволяет сосуществовать всем участникам.
Раздел для широкой публики
Найдите здесь свое выделенное место
en_sources_title
en_sources_text_start en_sources_text_end
Делиться - значит заботиться
Возможно, эта тема заинтересует ваших коллег. Почему бы не поделиться ею?
Разделы
Об этой статье
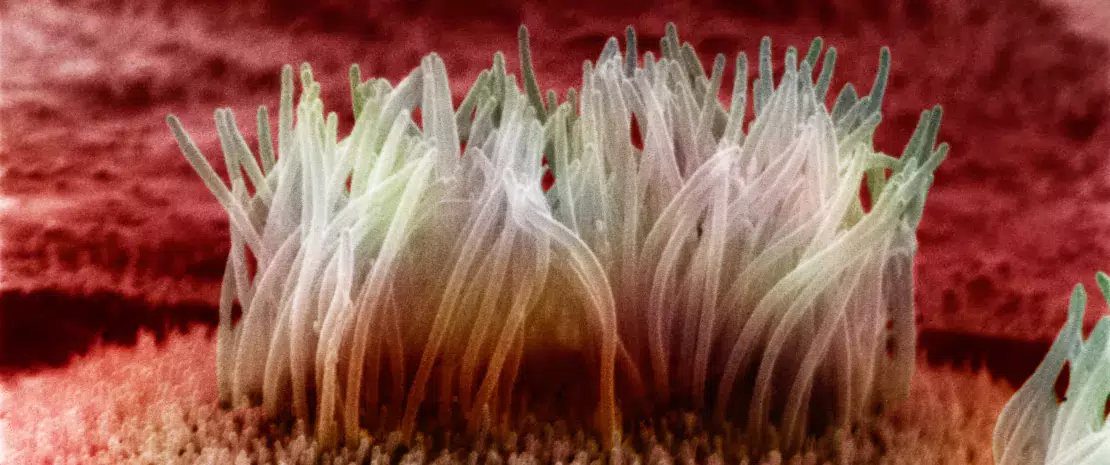
Эпителиальный барьер – это место контакта между иммунной системой и кишечной микробиотой и ключевой участок, где происходит подлинный диалог между иммунитетом хозяина и бактериями.
Содержащая 1014 микроорганизмов кишечная микробиота могла бы быстро захватить организм хозяина, если бы в процессе эволюции человека не было установлено мирное сосуществование. Кишечный барьер является основным компонентом, обеспечивающим это сосуществование: эпителиальные клетки кишечника выделяют густую слизь, из которой бактерии в просвете кишечника получают питательные ресурсы, не имея возможности пересечь этот барьер в условиях отсутствия патологии.
МНОГОФАКТОРНЫЙ БАЛАНС
Постоянный обмен между хозяином и микробиотой представляется ключевым фактором физиологического баланса кишечного иммунитета. В ворсинках и криптах тонкой кишки связывание бактерий с некоторыми рецепторами (NOD21 ) клеток Панета2 приводит к выработке противомикробных пептидов, таких как лизоцим. Активация бактериями Toll-подобных рецепторов (TLR) на уровне мембран эпителиальных и лимфоидных клеток запускает привлечение фагоцитов, лимфоцитов и дендритных клеток (клетки врожденного иммунитета), находящихся в субэпителиальном слое. Эта активация происходит по сигнальному пути ядерного фактора «каппа-би» (NF-kB), который регулируется короткоцепочечными жирными кислотами (КЦЖК), производимыми некоторыми бактериальными штаммами, и выработкой хемокинов и цитокинов3 . Таким образом, достигается баланс между целостностью слизистой оболочки кишечника, бактериальной активацией иммунной защиты и регуляцией ответов самой микробиоты. Повреждение хотя бы одного из этих звеньев цепи приводит к хроническим воспалительным процессам.

СПОСОБ РОДОРАЗРЕШЕНИЯ И КОРМЛЕНИЕ РЕБЕНКА – ДВА КЛЮЧЕВЫХ ФАКТОРА
У детей, появившихся на свет с помощью кесарева сечения, содержание В-лимфоцитов выше, чем у тех, кто родился через родовые пути, что является признаком более активного иммунитета уже в неонатальный период4 . Материнское молоко также способствует формированию естественной защиты и созреванию кишечника благодаря своему составу и является источником лизоцима, иммуноглобулинов A (антител на поверхности слизистой оболочки кишечника), каппа-казеина (продукты распада которого могут конкурировать с патогенами за рецепторы эпителиальных клеток кишечника у детей, находящихся на грудном вскармливании), лактоферрина, продукт распада которого, лактоферрицин, является противомикробным пептидом, обладающим бактериостатическим и бактерицидным действием. Кроме того, оно содержит около 109 бактерий/л, а также фруктан – пребиотик, способствующий развитию лакто- и бифидобактерий. Что касается детских смесей, они способствуют более активному размножению энтерококков и энтеробактерий5.
1 Нуклеотидсвязывающий домен олигомеризации 2
2 Эпителиальные клетки, расположенные на дне крипт тонкой кишки и задействованные в иммунной защите желудочно-кишечного тракта.
3 Gaboriau-Routhiau V, Cerf-Bensussan N. Microbiote intestinal et développement du système immunitaire. Médecine/Science. 2016
4 Clemente JC, Ursell LK, Parfrey LW, et al. The impact of the gut microbiota on human health: an integrative view. Cell. 2012;148(6):1258-1270.
5 Lazar V, Ditu LM, Pircalabioru GG, et al. Aspects of Gut Microbiota and Immune System Interactions in Infectious Diseases, Immunopathology, and Cancer. Front Immunol. 2018;9:1830.







