Cánceres digestivos y microbiota intestinal: de la oncogénesis a la respuesta a los tratamientos
Síntesis
Por el Pr. Iradj Sobhani
Gastroenterología, Universidad París Este Créteil (UPEC) y Hospital Universitario, Créteil, Francia
Espacio para el público general
Encuentra aquí tu espacio dedicado
en_sources_title
en_sources_text_start en_sources_text_end
Capítulos
Acerca de este artículo
Autor
El cáncer se ha convertido en la primera causa de mortalidad en numerosos países occidentales a causa de su creciente prevalencia. Actualmente, se considera más bien una enfermedad emergente debida al entorno que una patología inducida por anomalías genéticas constitucionales, que de hecho son poco frecuentes. Se trata de un cambio de paradigma favorecido por el desarrollo de las técnicas de biología molecular, por una mejor comprensión de los mecanismos y por la identificación de biomarcadores asociados. Desde hace varios decenios, los epidemiólogos han establecido una relación entre oncogénesis y alimentación, lo que tiende a otorgar a la microbiota intestinal –y por tanto a la disbiosis–, un lugar central en el estudio del cáncer. Esta asociación ha encontrado ahora una explicación mecanística, tanto en el plano energético como inflamatorio e inmunitario: algunas bacterias, favorecidas por la alimentación, pueden, justamento, influir la progresión tumoral, afectar la respuesta de los tumores a los tratamientos o los efectos secundarios resultantes.
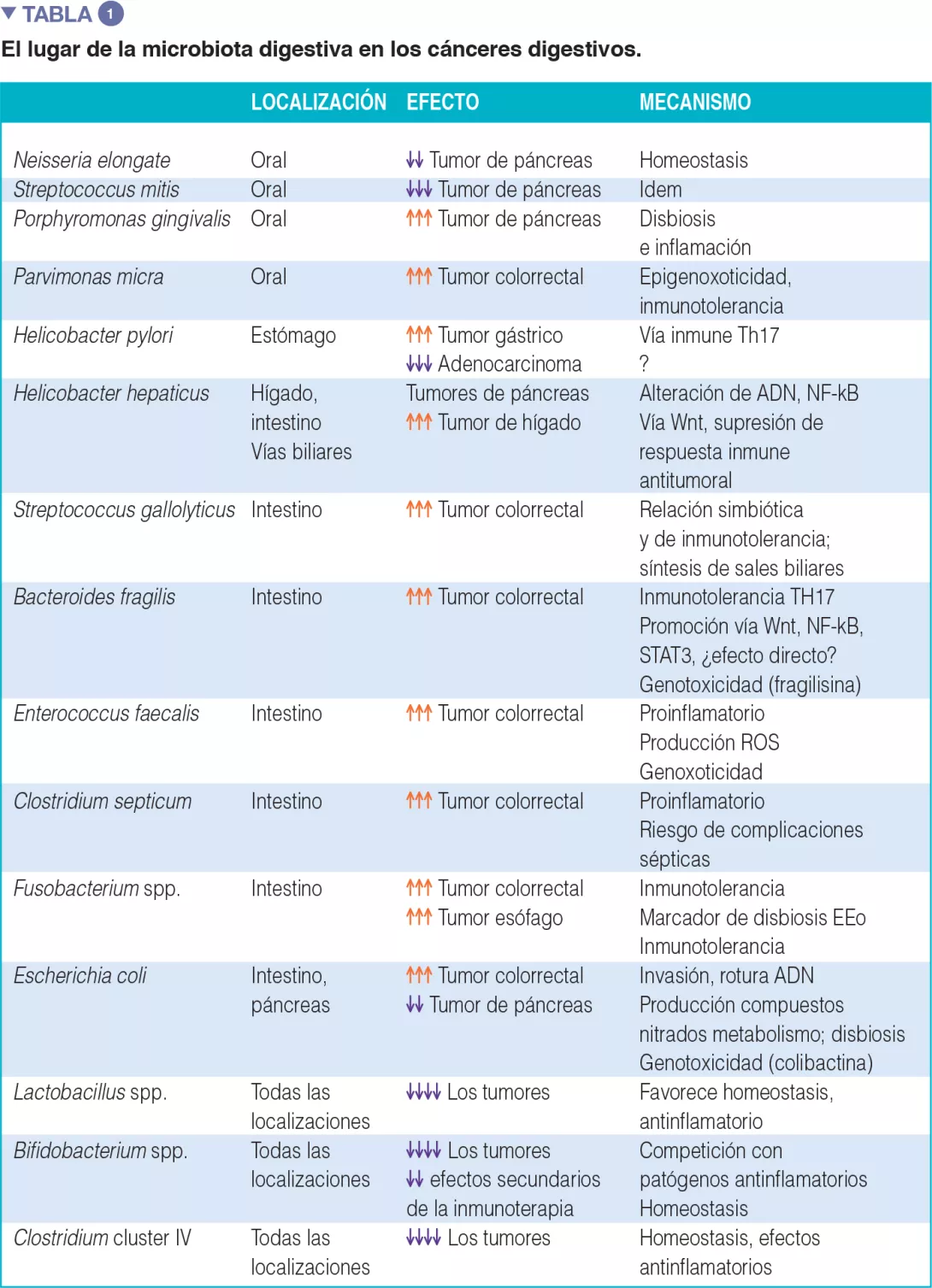
Las asociaciones entre ciertos cánceres y disbiosis, los mecanismos por los cuales la microbiota intestinal puede promover un cáncer en el ser humano, así como el inventario de los biomarcadores con fines diagnósticos y/o terapéuticos, en particular en el ámbito de las inmunoterapias anticancerígenas están recogidos en la tabla 1.
Como en el caso de la obesidad y la diabetes, se trata de identificar los marcadores bacterianos con un objetivo diagnóstico, pero también de estudiar las funciones de las bacterias para comprender mejor el impacto del entorno en las patologías.
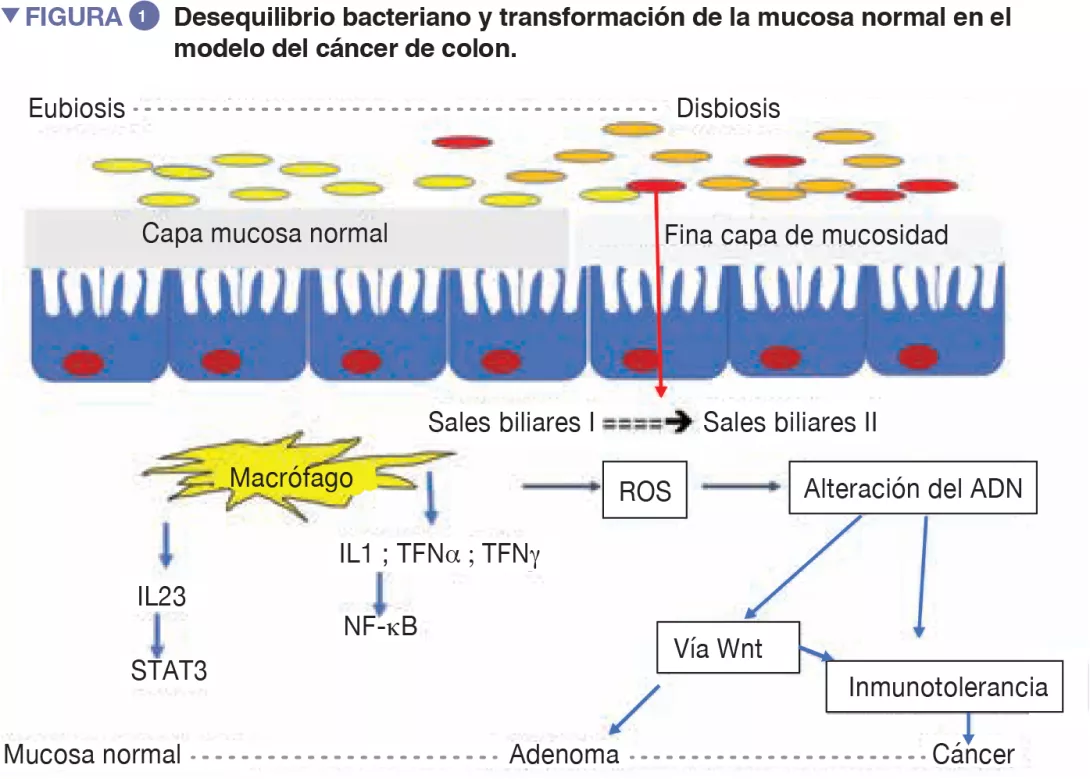
En pacientes obesos, por ejemplo, una alimentación desequilibrada en el plano cuantitativo y cualitativo puede afectar rápidamente a la microbiota intestinal, así como las funciones bacterianas [1]. La caracterización de su microbiota intestinal puede hacer emerger una disbiosis específica y permitir la evaluación de las probabilidades de éxito o de fracaso de un régimen alimenticio correctivo. Hay numerosas enfermedades emergentes, como los cánceres, que han experimentado desarrollos similares y que se benefician de estos avances en investigación fisiopatológica.( Figura 1).
Esófago-estómago
En condiciones fisiológicas, la microbiota del esófago se asemeja a la de la cavidad oral. Firmicutes, Bacteroidetes, Actinobacteria, Proteobacteria y Fusobacteria son los que tienen mayor representación y el género Streptococcus es dominante a nivel esofágico. En caso de reflujo gastroesofágico (ERGE) o de endobraquioesófago (EBO), condiciones que favorecen las situaciones preneoplásicas, se observa una microbiota más similar a la del estómago, caracterizada por la abundancia de Bacteroidetes, Proteobacteria y Fusobacterium. Helicobacter pylori, bacteria identificada como un cofactor de las neoplasias gástricas (cáncer y linfoma-MALT), parece paradójicamente protectora frente a los adenocarcinomas esofágicos, en emergencia en los países occidentales. En realidad, hay diferentes especies bacterianas, distintas de H. pylori, como Pasteurella stomatis, Dialister pneumosintes, Slakia exigua, Parvimonas micra y Streptococcus anginosus, que desempeñan una función de promoción tumoral gástrica. Hay trabajos recientes que sugieren que las Enterobacteriaceae, en particular el Ruminococcus podrían desempeñar una función importante en el escape al control inmunitario antitumoral de los adenocarcinomas gástricos y esofágicos [2].
Cáncer colorrectal (ccr) y modelo de estudio de escape tumoral a la respuesta inmune
Disbiosis cólica ligada al CCR [3, 4], la hipótesis de que la flora oral participaba en la disbiosis implicada en la génesis del CCR se ha reactualizado a la luz de los trabajos originales sobre la capacidad de ciertas bacterias orales para superar el filtro gástrico y de participar en la disbiosis cólica [5]. Los desequilibrios bacterianos se producen a menudo en detrimento de bacterias beneficiosas como Bifidobacteria y Lactobacilli, que contribuyen a mantener la respuesta inmune [2]. Cuando estas bacterias ya no pueden hacer de contrapeso frente a las bacterias proinflamatorias, se instala una inflamación crónica asintomática de la mucosa cólica, conocida desde hace tiempo por favorecer el proceso carcinógeno. Últimamente, se considera que la alimentación actual de tipo occidental (demasiado rica en proteínas animales y en azúcares) favorece las bacterias proinflamatorias en detrimento de bacterias antinflamatorias. Y, al contrario, una alimentación de tipo mediterráneo (rica en fibras vegetales) limita los efectos nocivos [6]. A falta de un aporte suficiente de fibras, las bacterias reclutadas por el consumo excesivo de proteínas o de grasas animales erosionan la mucosidad, la utilizan como fuente de fibras, y exponen el epitelio intestinal a bacterias potencialmente virulentas (Figura 1). A escala celular, las grandes vías biológicas como la vía Wnt y la vía común NF-kB (nuclear factor-kappa B), que originan respectivamente la renovación celular y una mayor producción de citoquinas proinflamatorias, se estimulan gracias a esta alimentación [6]. Se puede asociar a este fenómeno una orientación de la respuesta inmune hacia la tolerancia debida a la sobreabundancia de otras bacterias como Parvimonas micra y Streptococcus fragilis [7]. En animales, Bacteroides fragilis o Escherichia coli, que forman parte del panel de bacterias sobreabundantes en caso de CCR en un estadio avanzado (III o IV de TNM), mantienen la estimulación inflamatoria en la mucosa cólica y favorecen la aparición de tumores [8].
Carcinoma hepatocelular (chc)
Los tumores primitivos del hígado ocurren tras un proceso crónico que incluye la cirrosis, que a su vez es el resultado de una infección viral inducida por el VHB o el VHC. Hay mecanismos epigenéticos secundarios a la acción de los microorganismos que suponen una extinción de ciertos genes clave como p16 (INK4A), glutatión S-transferasa P 1 (GSTP1), CDH1 (E-cadherina), Ras association domain containing protein 1 (RASSF1A), p21 (WAF1/CIP1) todos hipermetilados por el VHB, así como ciertos genes supresores de citocinas 1 (SOCS-1), y el de STAT1, hipermetilados por el VHC. Estos genes retrasan la aparición del cáncer, pero la hipermetilación inhibe su expresión. Existen bacterias que pueden intervenir como factores de promoción en estos procesos: Helicobacter hepaticus aumenta el riesgo carcinógeno, bien directamente por la activación de la vía Wnt y la de NF-kB, bien como facilitador del proceso inducido por VHC. Al igual que ciertos elementos del entorno (virus, contaminantes químicos, etc.), algunas enterobacterias, como E. coli, se identifican como cofactores de activación del proceso carcinógeno. En el ámbito del metabolismo, el desequilibrio Firmicutes/ Bacteroidetes, conocido como factor de riesgo de obesidad, favorece el riesgo de CHC por la bajada de bacterias protectoras como Lactobacillus, Bifidobacterium, Parabacteroides y Oscillibacter [9, 10].
Cáncer de páncreas
En los pacientes afectados por cáncer de páncreas, se han detectado densidades elevadas de Enterobacteriaceae, Pseudomonadaceae, Moraxellaceae y Enterococcaceae en el tejido tumoral; también las de Acinetobacter, Aquabacterium, Oceanobacillus, Rahnella, Massilia, Delftia, Deinococcus, y Sphingobium son elevadas en la zona luminal duodenal. Al igual que en el CCR, la disbiosis relacionada con este cáncer incluye además la modificación de la flora oral, caracterizada por una sobreabundancia de Porphyromonas gingivalis o la escasez de Neisseria elongate y Streptococcus mitis. Esto lleva a destacar una vez más la asociación entre disbiosis bacteriana intestinal y cáncer digestivo. En el plano terapéutico, es importante señalar que las Gammaproteobacteria pueden aumentar la resistencia a la gemcitabina, tratamiento de referencia de los cánceres de páncreas.
Respuesta inmune antitumoral y disbiosis
Los animales axénicos (libres de gérmenes) padecen menos tumores, sin duda a causa de una inmunotolerancia y de una menor actividad inflamatoria reaccional, que pueden explicarse por la ausencia de una microbiota fisiológica. La microbiota puede contribuir a la carcinogénesis a través de mecanismos diferentes: en primer lugar, por la activación inflamatoria por disbiosis y reorientación del sistema inmunitario; la producción de genotoxinas (colibactina, fragilisina) y de factores de virulencia por las bacterias capaces de alterar directamente el ADN del hospedador; o por la inducción de un estrés oxidativo por la producción de especies reactivas del oxígeno (ROS); por último, por la producción de metabolitos secundarios por las bacterias (ácidos biliares secundarios...). En el modelo del colon, por ejemplo, se observan 4 subtipos diferentes que corresponden a vías metabólicas, inmunitarias o inflamatorias diferentes [11]. En el subtipo de CCR infiltrado por los linfocitos T (LT), se observa la disminución de la capacidad de los LT para expresar citocinas o para atacar a las células objetivo a causa de una estimulación persistente por antígenos tumorales. Este fenómeno se describe como un agotamiento de LT. Es el mecanismo más corriente de evasión inmunitaria. Sea cual sea el reclutamiento linfocitario inicial, citotóxico o facilitador, el tumor continuará desarrollándose [9]. Las células linfocitarias T reguladoras (LTreg) facilitarán el efecto inmunosupresor mediante la producción de factores como TGF-β. Las LT-reg se reclutarán preferiblemente en la fase de agotamiento. Además, la densidad intratumoral de las LT-reg es un marcador de pronóstico desfavorable. Al producir citocinas inmunosupresoras (IL-10 y TGF-β), las células T-reg reducen la acción específica de las LT citotóxicas dirigida normalmente contra la célula tumoral. En particular, aumentan la molécula inhibidora asociada a la expresión de la proteína 4 (CTLA-4 o CD 152) de estos linfocitos. Esta proteína se ha convertido en un objetivo de las inmunoterapias modernas. Los LT-regs actúan con ayuda de los LTh17 así como con STAT3 (Signal Transducer and Activator of Transcription 3), implicados en la cancerogénesis de diversos órganos. El LTh17 produce citocinas proinflamatorias (IL-17 e IL-23) que favorecen el crecimiento tumoral aumentando la producción de citocinas Th1 y la de un ligando de quimiocina (motivo C-X-C)9 y 10 (CXCL9 y CXCL10). Las células Th17 tienen características similares a las células madre y son capaces de renovarse. El entorno citocínico presente en el foco tumoral influye en los diferentes modelos de expresión de las células Th17: en los cánceres colorrectales, hepatocelulares y pancreáticos, la infiltración de LTh17 está asociada a un mal pronóstico, porque favorece la tolerancia inmunitaria al tumor. La disbiosis adherente a las mucosas modula la expresión de IL17, IL-23 y STAT3.
Microbiota y tratamiento de los cánceres
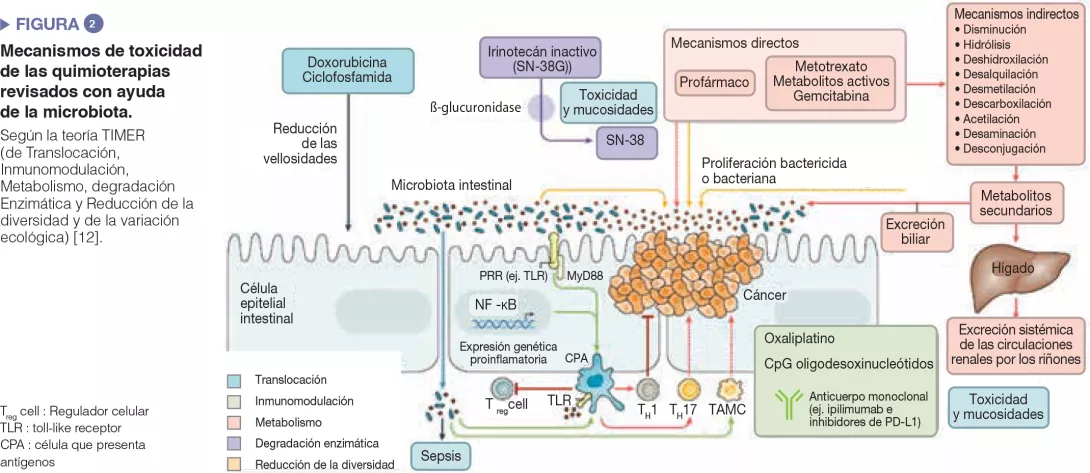
La capacidad de la microbiota intestinal para modular la respuesta a la quimioterapia anticancerígena y a la inmunoterapia se ha observado en ratones y en seres humanos. Los carcinomas de pulmón, de riñón, y el melanoma han sido objeto de estudios clínicos. Esta influencia nunca se puede atribuir a una sola especie: en todos los casos, se trata del impacto de una comunidad microbiana intestinal en su conjunto sobre la inmunidad o una función compartida por diferentes bacterias. Estas últimas influyen en los efectos secundarios o en la resistencia terapéutica (Figura 2). A modo de ejemplo, la actividad citidina- deaminasa de las proteobacterias, en particular de Mycoplasma hyorhinis, metaboliza la gemcitabina y reduce su eficacia. Del mismo modo, la ciclofosfamida presenta efectos antitumorales variables según la dosis administrada; las bacterias grampositivas (como Enterococcus hirae) y gramnegativas (como Barnesiella intestinihominis) modulan su eficacia [12].
ias antineoplásicas en el melanoma maligno. Se trata de los tratamientos más prometedores que actúan sobre las moléculas del punto de control inmunitario como por ejemplo PD-1 y CTLA-4. En primer lugar, se ha constatado que en pacientes afectados por un cáncer metastásico renal o pulmonar, la utilización de un tratamiento antibiótico podría modular la actividad de las inmunoterapias anti-PD-1 o anti-PD-L1 [13]. Después, un vasto estudio americano realizado en el melanoma maligno metastático tratado por inmunoterapia ha revelado que la buena respuesta (supervivencia sin progresión y supervivencia global mayor) al tratamiento dependía de la composición microbiana cólica: la transferencia de microbiota intestinal de los pacientes en un modelo con ratones mostraba que la disbiosis intestinal era efectivamente el origen de la variabilidad de la respuesta a la inmunoterapia de tipo anti-PD-1 [14, 15].
Hay que vincular estos datos con los de los polimorfismos de TLR4, que están relacionados con la variabilidad de la respuesta a la inmunoterapia. Los TLR (toll-like receptors) son transmembranarios o citosólicos; forman parte de la gran familia de receptores de la inmunidad innata PRR (pattern recognition receptors), expresados por las células epiteliales y las células inmunitarias en el intestino. La unión de un TLR con el ligando microbiano provoca una cascada de señalización intracelular que generalmente desemboca en una respuesta de tipo inflamatorio por activación de NF-kB. El estado inmunitario del hospedador ha demostrado ser el factor principal en la respuesta a todos los tratamientos antineoplásicos, directamente y por alteraciones de la microbiota intestinal. Además, los otros elementos terapéuticos como la radioterapia y la cirugía también se ven impactados por la microbiota: los ratones axénicos presentan menos toxicidad ante las radiaciones ionizantes que los ratones convencionales; la cicatrización posoperatoria en los pacientes operados de cáncer de colon depende del tipo de disbiosis.
Conclusión
La composición microbiana cólica se ve influida por los factores del entorno y puede influir en la génesis y la progresión de los tumores malignos por la vía del metabolismo, de la inflamación o de la inmunidad. La resistencia a los tratamientos antitumorales así como la aparición de ciertos efectos secundarios de estos tratamientos son objeto de estudios. Es probable que, en el futuro, la modulación de la microbiota intestinal se convierta en un medio para optimizar los tratamientos antitumorales.






