Cancers digestifs et microbiote intestinal : de l’oncogenèse à la réponse aux traitements
Synthèse
Par le Pr. Iradj Sobhani
Gastro-entérologie Université Paris est Créteil (UPEC), CHU Henri-Mondor, Créteil, France
Section grand public
Retrouvez ici votre espace dédié
en_sources_title
en_sources_text_start en_sources_text_end
Chapitres
A propos de cet article
Auteur
Devenus première cause de mortalité dans de nombreux pays occidentaux en raison de leur prévalence croissante, les cancers sont à présent davantage considérés comme des maladies émergentes dues à l’environnement que comme des pathologies induites par des anomalies génétiques constitutionnelles – finalement peu fréquentes. Un changement de paradigme favorisé par le développement des techniques de biologie moléculaire, par une meilleure compréhension des mécanismes et par l’identification de biomarqueurs associés. Depuis plusieurs décennies, les épidémiologistes établissent une relation entre oncogenèse et alimentation, ce qui tend à conférer au microbiote intestinal – donc à la dysbiose – une place centrale dans l’étude des cancers. Cette association trouve désormais une explication mécanistique, tant sur le plan énergétique qu’inflammatoire et immunitaire : favorisées par l’alimentation, certaines bactéries peuvent en particulier influencer la progression tumorale, impacter la réponse des tumeurs aux traitements ou les effets secondaires qui en résultent.
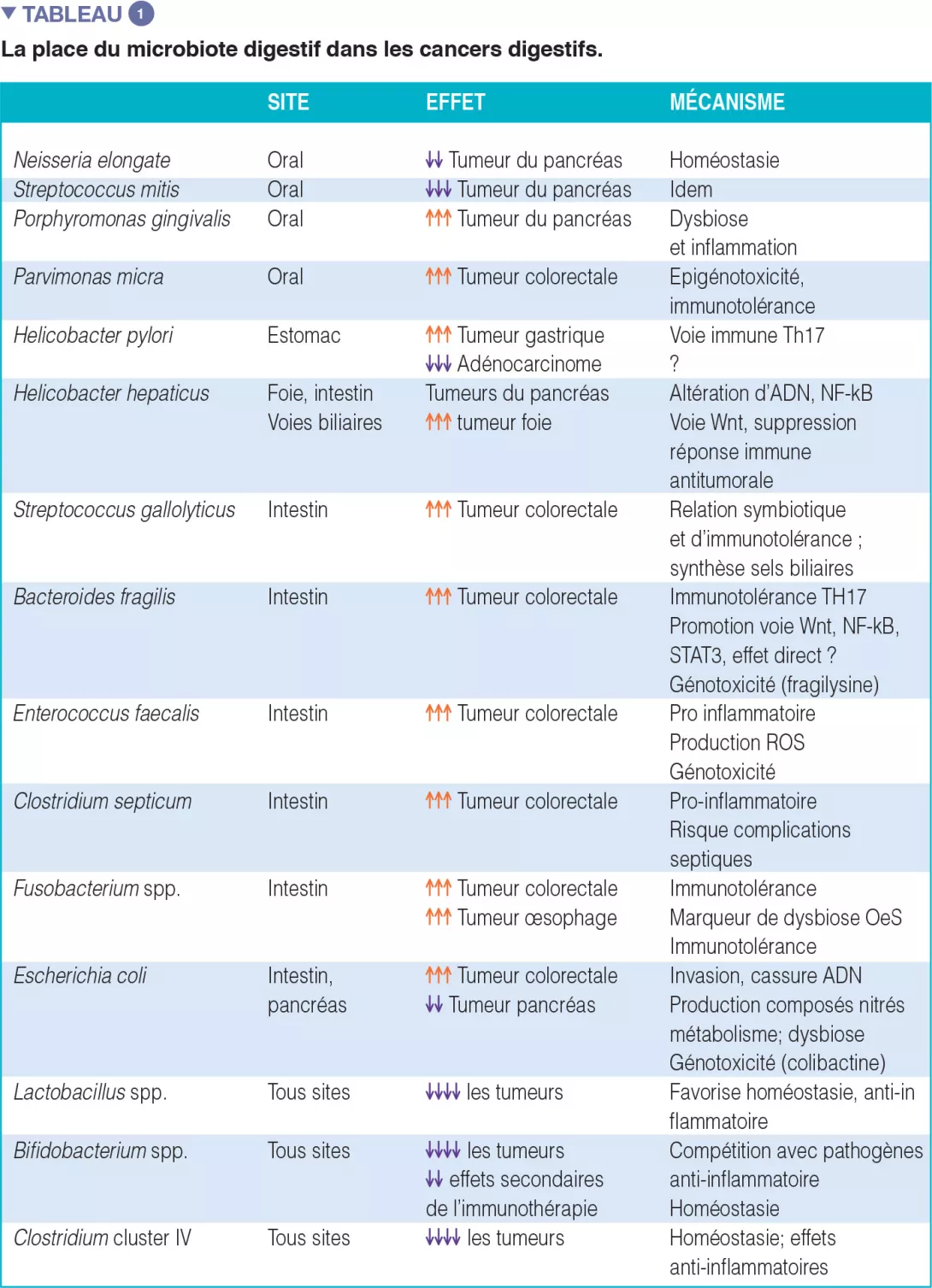
Les associations entre certains cancers et des dysbioses (mécanismes par lesquels le microbiote intestinal peut promouvoir un cancer chez l’homme) sont résumées dans le tableau 1. Il en va de même pour l’inventaire des biomarqueurs à des fins diagnostiques et/ou thérapeutiques, en particulier dans le domaine des immunothérapies anti cancéreuses.
Comme pour l’obésité et le diabète, il s’agit d’identifier les marqueurs bactériens à visée diagnostique, mais également d’étudier les fonctions des bactéries pour mieux comprendre l’impact de l’environnement sur les pathologies.
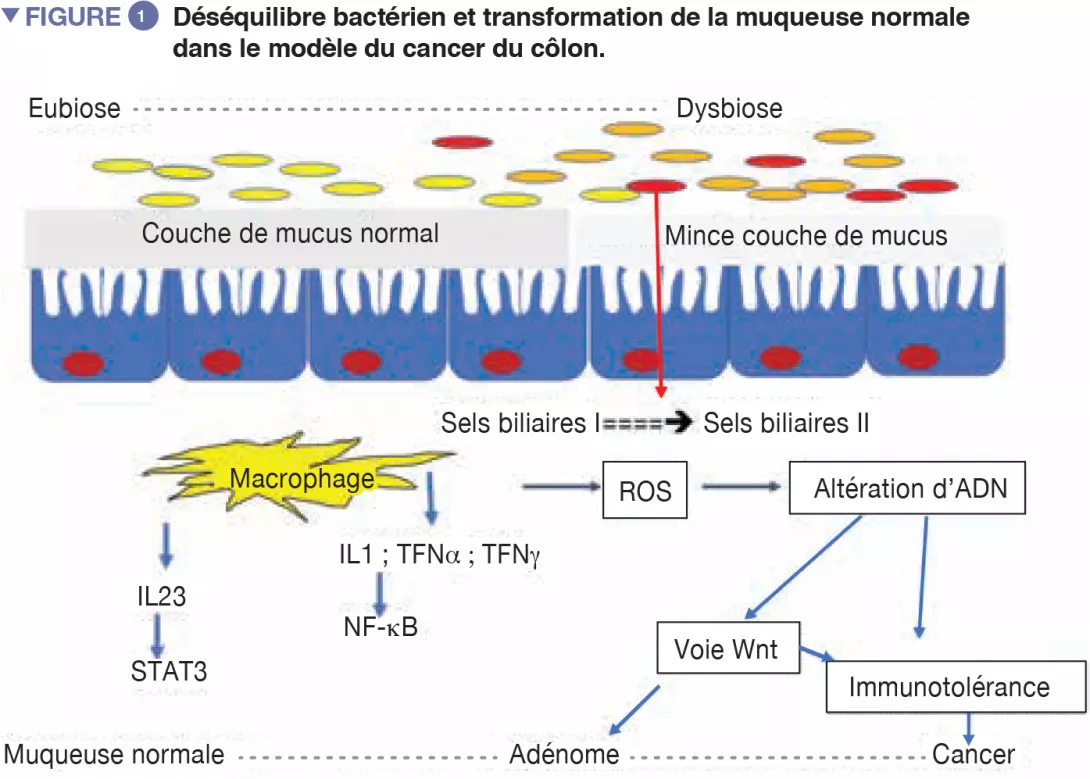
Chez les patients obèses par exemple, une alimentation déséquilibrée sur le plan quantitatif et qualitatif peut rapidement affecter le microbiote intestinal ainsi que les fonctions bactériennes [1]. La caractérisation de leur microbiote intestinal peut faire émerger une dysbiose spécifique et permettre l’évaluation des probabilités de succès ou d’échec d’un régime alimentaire correctif. De nombreuses maladies émergentes, comme les cancers, ont connu des développements similaires et bénéficient de nouvelles pistes de recherche physiopathologiques (Figure 1).
Oesophage-estomac
Dans des conditions physiologiques, le microbiote de l’oesophage se rapproche de celui de la cavité orale. Les Firmicutes, Bacteroidetes, Actinobacteria, Proteobacteria, Fusobacteria sont les plus représentés et le genre Streptococcus est dominant au niveau oesophagien. En cas de reflux gastro-oesophagiens (RGO) ou d’un endobrachyoesophage (EBO), conditions favorisant les situations prénéoplasiques, on note un microbiote plus proche de celui de l’estomac, caractérisé par l’abondance de Bacteroidetes, Proteobacteria et Fusobacterium. Helicobacter pylori, bactérie identifiée comme un co-facteur des néoplasies gastriques (cancer et lymphome-MALT), semble paradoxalement protectrice contre les adénocarcinomes oesophagiens, en émergence dans les pays occidentaux. En réalité, différentes espèces bactériennes, autres que H. pylori, telles que Pasteurella stomatis, Dialister pneumosintes, Slakia exigua, Parvimonas micra et Streptococcus anginosus, jouent un rôle de promotion tumorale gastrique. Des travaux récents ont suggéré que les Enterobacteriaceae, en particulier le Ruminococcus pourraient jouer un rôle important dans l’échappement au contrôle immunitaire antitumoral des adénocarcinomes gastriques et oesophagiens [2].
Cancer colorectal (ccr) et modèle d’étude d’échappement tumoral à la réponse immune
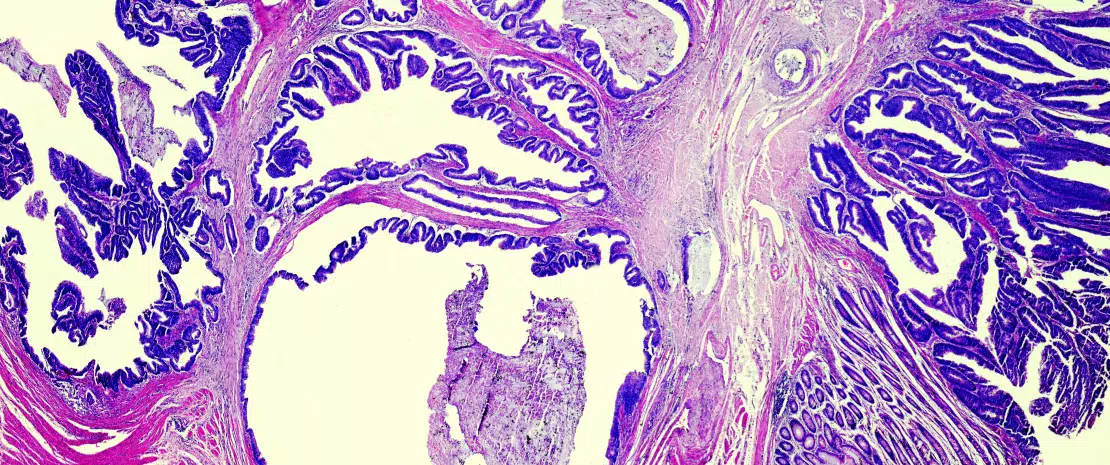
Depuis les premières descriptions d’une dysbiose colique liée au CCR [3, 4], l’hypothèse que la flore orale participerait à la dysbiose impliquée dans la genèse du CCR est réactualisée à la lumière des travaux originaux sur la capacité de certaines bactéries orales à franchir le filtre gastrique et à participer à la dysbiose colique [5]. Les déséquilibres bactériens se font souvent au détriment des bactéries bénéfiques telles Bifidobacteria et Lactobacilli, qui contribuent au maintien de la réponse immune [2]. Ces bactéries ne pouvant plus assurer le contrepoids des bactéries pro-inflammatoires, s’installe alors une inflammation chronique asymptomatique de la muqueuse colique, connue depuis fort longtemps pour favoriser le processus carcinogène. Désormais, l’actuel régime alimentaire de type occidental (trop riche en protéines animales et en sucres) est réputé favoriser les bactéries pro-inflammatoires au détriment de bactéries anti- inflammatoires. Au contraire, un régime de type méditerranéen (riche en fibres végétales) en limite les méfaits [6]. En l’absence d’un apport suffisant en fibres, les bactéries recrutées par la surconsommation de protéines ou de graisses animales érodent le mucus, pris comme source de fibres, et exposent l’épithélium intestinal à des bactéries potentiellement virulentes (Figure 1). À l’échelle cellulaire, les grandes voies biologiques telles la voie Wnt et la voie commune NF-kB (nuclear factorkappa B), à l’origine respectivement du renouvellement cellulaire et d’une plus grande production de cytokines pro-inflammatoires, sont stimulées par cette alimentation [6]. On peut associer à ce phénomène celui d’une orientation de la réponse immune vers la tolérance due à la surabondance d’autres bactéries comme Parvimonas micra et Streptococcus fragilis [7]. Chez l’animal, Bacteroides fragilis ou Escherichia coli, qui font partie du panel des bactéries surabondantes en cas de CCR à un stade avancé (III ou IV de TNM), entretiennent la stimulation inflammatoire dans la muqueuse colique et favorisent la survenue de tumeurs [8].
Carcinome hépatocellulaire (chc)
Les tumeurs primitives du foie surviennent après un processus chronique incluant la cirrhose, elle-même résultat d’une infection virale induite par le VHB ou le VHC. Des mécanismes épigénétiques secondaires à l’action des micro-organismes entraînent une extinction de certains gènes-clés tels que p16 (INK4A), glutathione S-transférase P 1 (GSTP1), CDH1 (E-cadherine), Ras association domain containing protein 1 (RASSF1A), p21 (WAF1/CIP1) tous hyperméthylés par le VHB ainsi que certains gènes suppresseurs de cytokines 1 (SOCS- 1), et celui de STAT1, hyperméthylés par le VHC. Ces gènes retardent la survenue du cancer mais l’hyperméthylation inhibe leur expression. Des bactéries peuvent intervenir comme facteurs de promotion dans ces processus : Helicobacter hepaticus augmente le risque carcinogène, soit directement par l’activation de la voie Wnt et celle de NF-kB, soit comme facilitateur du processus VHC-induit. De même que certains éléments de l’environnement (virus, polluants chimiques, etc.), certaines entérobactéries, comme E. coli, sont identifiées comme co-facteurs d’activation du processus carcinogène. Dans le domaine du métabolisme, le déséquilibre Firmicutes/ Bacteroidetes, connu comme facteur de risque d’obésité, favorise le risque de CHC par la baisse des bactéries protectrices telles que Lactobacillus, Bifidobacterium, Parabacteroides et Oscillibacter [9, 10].
Cancer du pancréas
Chez les patients atteints de cancer du pancréas, des densités élevées d’Enterobacteriaceae, Pseudomonadaceae, Moraxellaceae et Enterococcaceae sont détectées au niveau du tissu tumoral ; celles d’Acinetobacter, Aquabacterium, Oceanobacillus, Rahnella, Massilia, Delftia, Deinococcus, et Sphingobium sont élevées au niveau luminal duodénal. Comme dans le CCR, la dysbiose liée à ce cancer inclut par ailleurs la modification de la flore orale, caractérisée par une surabondance de Porphyromonas gingivalis ou la sous-abondance de Neisseria elongate et Streptococcus mitis. De quoi souligner, une fois encore, l’association entre dysbiose bactérienne intestinale et cancer digestif. Sur le plan thérapeutique, il est important de noter que les Gammaproteobacteria peuvent augmenter la résistance à la gemcitabine, traitement de référence des cancers du pancréas.
Réponse immune antitumorale et dysbiose
Les animaux axéniques (dépourvus de germes) développent moins de tumeurs, sans doute en raison d’une immunotolérance et d’une moindre activité inflammatoire réactionelle, ces derniers pouvant s’expliquer par l’absence d’un microbiote physiologique. Le microbiote peut contribuer à la carcinogénèse par différents mécanismes : tout d’abord, l’activation inflammatoire par dysbiose et réorientation du système immunitaire ; la production de génotoxines (colibactine, fragilysine) et de facteurs de virulence par les bactéries capables d’altérer directement l’ADN de l’hôte ; ou encore l’induction d’un stress oxydatif par la production de réactifs de l’oxygène (ROS) ; enfin la production de métabolites secondaires par les bactéries (acides biliaires secondaires…). Dans le modèle du côlon, par exemple, on note 4 sous-types distincts correspondant à des voies métaboliques, immunitaires ou inflammatoires différentes [11]. Dans le sous-type de CCR infiltré par les lymphocytes T (LT), on note la diminution de la capacité des LT à exprimer des cytokines ou à attaquer les cellules cibles en raison d’une stimulation persistante par des antigènes tumoraux. Ce phénomène est décrit comme un épuisement de LT. C’est le mécanisme le plus courant d’évasion immunitaire. Quel que soit le recrutement lymphocytaire initial, cytotoxique ou facilitateur, la tumeur continuera à se développer [9]. Des cellules lymphocytaires T régulatrices (LT-reg) faciliteront l’effet immunosuppresseur par le biais de la production de facteurs tel que TGF-β. Les LT-reg seront préférentiellement recrutés dans la phase d’épuisement. D’ailleurs, la densité intra tumorale des LT-reg est un marqueur de pronostic défavorable. En produisant des cytokines immunosuppressives (IL-10 et TGF-β), les cellules T-reg réduisent l’action spécifique des LT cytotoxiques dirigée normalement contre la cellule tumorale. En particulier, ils augmentent la molécule inhibitrice associée à l’expression de la protéine 4 (CTLA-4 ou CD 152) de ces lymphocytes. Cette protéine est devenue une cible des immunothérapies modernes. Les LT-regs agissent à l’aide des LTh17 ainsi qu’avec STAT3 (Signal Transducer and Activator of Transcription 3), impliqués dans la cancérogenèse de divers organes. Le LTh17 produit des cytokines pro-inflammatoires (IL-17 et l’IL-23) qui favorisent la croissance tumorale en augmentant la production de cytokines Th1 et celle d’un ligand de chimiokine (motif C-X-C) 9 et 10 (CXCL9 et CXCL10). Les cellules Th17 ont des caractéristiques similaires aux cellules souches et sont capables de se renouveler. L’environnement cytokinique présent au site tumoral influence les différents modèles d’expression des cellules Th17 : dans les cancers colorectaux, hépatocellulaires et pancréatiques, l’infiltration de LTh17 est associée à un mauvais pronostic car il favorise la tolérance immunitaire à la tumeur. La dysbiose adhérente aux muqueuses, module l’expression des IL17, IL-23, STAT3.
Microbiote et traitement des cancers
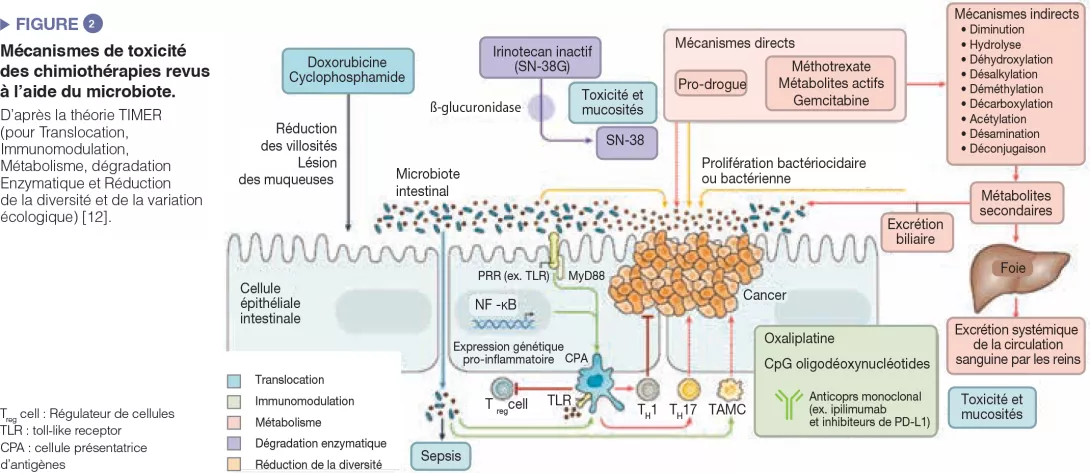
La capacité du microbiote intestinal à moduler la réponse à la chimiothérapie anticancéreuse et à l’immunothérapie a été notée chez la souris et chez l’homme. Les carcinomes du poumon, du rein, et le mélanome ont fait l’objet d’études cliniques. Cette influence n’est jamais attribuable à une espèce seule : dans tous les cas, il s’agit de l’impact d’une communauté microbienne intestinale dans son ensemble sur l’immunité ou une fonction partagée par différentes bactéries. Ces dernières influencent les effets secondaires ou la résistance thérapeutique (Figure 2). À titre d’exemple, l’activité cytidine-désaminase des protéobactéries, en particulier de Mycoplasma hyorhinis, métabolise la gemcitabine et en réduit l’efficacité. De même, le cyclophosphamide présente des effets antitumoraux variables selon la dose administrée ; des bactéries à gram-positif (dont Enterococcus hirae) et à gram-négatif (dont Barnesiella intestinihominis) en modulent l’efficacité [12]. Les immunothérapies antinéoplasiques ont été utilisées avec succès dans le mélanome malin. Il s’agit des thérapeutiques les plus prometteuses qui agissent sur les molécules du point de contrôle immunitaire comme la cible PD-1 et CTLA-4. D’abord, il a été constaté que chez des patients atteints d’un cancer métastatique rénal ou pulmonaire, l’utilisation d’un traitement antibiotique pourrait moduler l’activité des immunothérapies anti-PD-1 ou anti-PD-L1 [13]. Ensuite, une large étude américaine menée dans le mélanome malin métastatique traité par immunothérapie a révélé que la bonne réponse au traitement (survie sans progression et survie globale plus grande) dépendait de la composition microbienne colique : le transfert de microbiote intestinal des patients dans un modèle murin montrait que la dysbiose intestinale était bien à l’origine de la variabilité de la réponse à l’immunothérapie de type anti-PD-1 [14, 15]. Ces données sont à rapprocher de celles sur les polymorphismes de TLR4, liés à la variabilité de la réponse à l’immunothérapie. Les TLR (toll-like receptors) sont transmembranaires ou cytosoliques ; ils font partie de la grande famille des récepteurs de l’immunité innée PRR (pattern recognition receptors), exprimés par les cellules épithéliales et les cellules immunitaires au niveau de l’intestin. La liaison d’un TLR avec le ligand microbien entraîne une cascade de signalisation intracellulaire aboutissant généralement à une réponse de type inflammatoire par activation de NF-kB. Le statut immunitaire de l’hôte s’avère être le facteur principal dans la réponse à tous les traitements antinéoplasiques, directement et par des altérations du microbiote intestinal. De plus, les autres volets thérapeutiques comme la radiothérapie et la chirurgie sont également impactés par le microbiote : les souris axéniques présentent moins de toxicité aux radiations ionisantes que les souris conventionnelles ; la cicatrisation postopératoire chez les patients opérés d’un cancer du côlon dépend du type de dysbiose.
Conclusion
La composition microbienne colique est influencée par les facteurs de l’environnement et peut influencer la genèse et la progression des tumeurs malignes par la voie du métabolisme, de l’inflammation ou de l’immunité. La résistance aux traitements anti tumoraux ainsi que l’apparition de certains effets secondaires de ces traitements font l’objet d’études. Il est probable que la modulation du microbiote intestinal devienne à l’avenir un moyen d’optimiser les traitements antitumoraux.






