РАК ПИЩЕВАРИТЕЛЬНОЙ СИСТЕМЫ И МИКРОБИОТА КИШЕЧНИКА: ОТ ОНКОГЕНЕЗА ДО ОТВЕТА НА ЛЕЧЕНИЕ
ОБЗОРНАЯ СТАТЬЯ
Автор: проф. Ирадж Собхани (Iradj Sobhani)
Гастроэнтерология, Университет Париж – Восточный Кретей (UPEC) и Университетская больница Анри Мондора, Кретей, Франция
Раздел для широкой публики
Найдите здесь свое выделенное место
en_sources_title
en_sources_text_start en_sources_text_end
Делиться - значит заботиться
Возможно, эта тема заинтересует ваших коллег. Почему бы не поделиться ею?
Разделы
Об этой статье
Автор
В условиях растущей распространенности рака, которая делает его основной причиной смерти во многих западных странах, в настоящее время он рассматривается скорее как эмерджентное заболевание, возникающее в результате влияния факторов окружающей среды, чем как заболевание, вызванное конституциональными генетическими отклонениями, которые, как теперь известно, встречаются гораздо реже, чем считалось ранее. Произошла смена парадигмы, чему благоприятствует развитие методов молекулярной биологии, лучшее понимание основных механизмов развития заболевания и идентификация связанных биомаркеров. В течение нескольких десятилетий эпидемиологи наблюдали связь между раком и диетой, благодаря чему микробиота кишечника и, следовательно, дисбиоз стали основным направлением в исследованиях рака. В настоящее время нашлось механистическое объяснение этой связи, включающее энергетический метаболизм, воспаление и иммунитет: в зависимости от диеты некоторые бактерии могут влиять на прогрессирование опухоли, на эффективность противоопухолевой терапии и на побочные эффекты этого лечения.
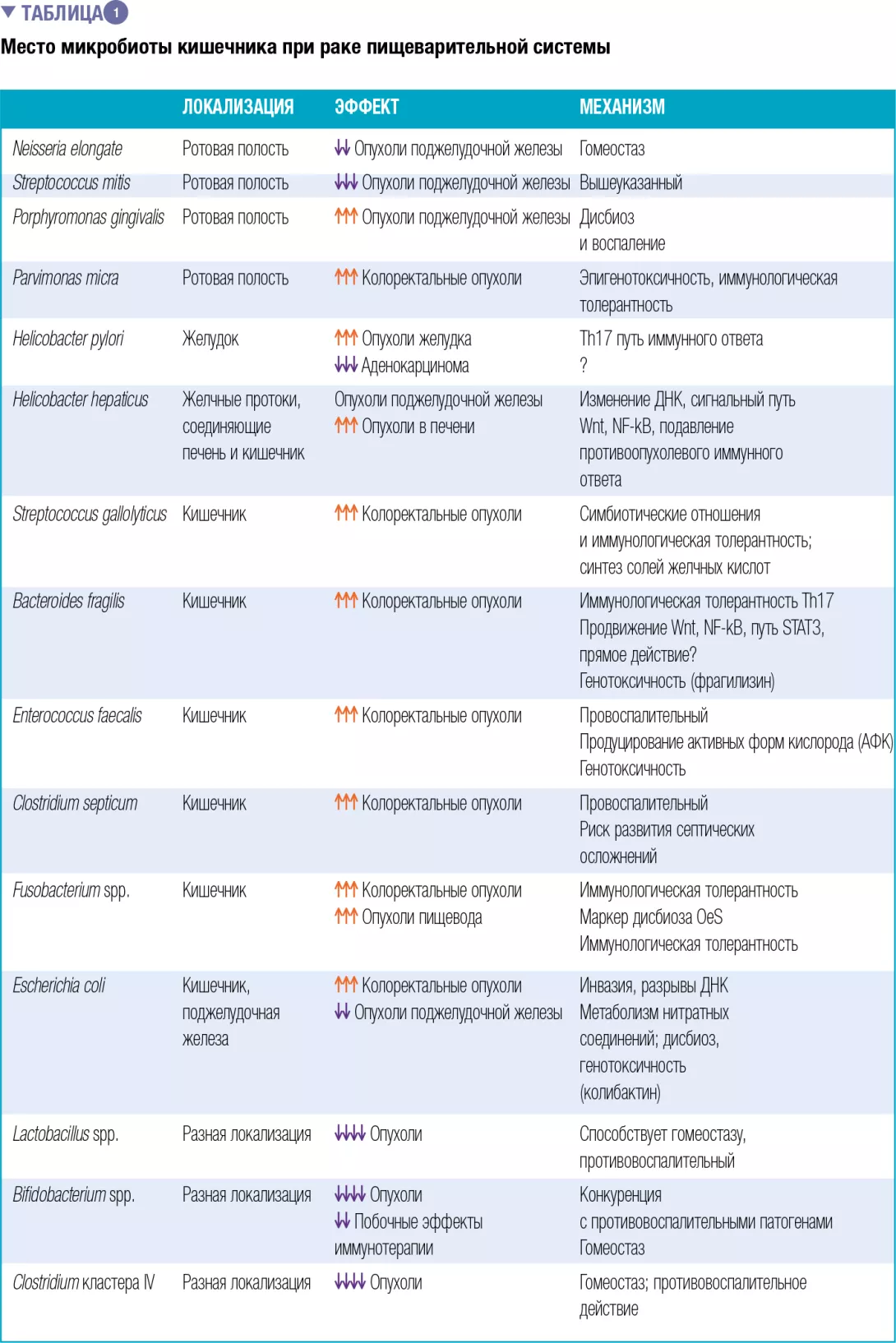
В таблице 1 представлена связь между некоторы- ми видами рака и дисбиозом, механизмы, с помощью которых кишечная микробиота может способствовать развитию рака у человека, и перечень диагностиче- ских и/или терапевтических биомаркеров, особенно в противоопухолевой иммунотерапии.
Как и в случае ожирения и диабета, важно идентифи- цировать бактериальные маркеры для диагностиче- ских целей, а также изучать бактериальные функции, чтобы лучше понять влияние окружающей среды на эти виды рака.
Например, у людей с ожирением несбалансированное питание с точки зрения количества и качества может быстро изменить микробиоту кишечника и функции составляющих ее бактерий [1]. Характеризуя микро- биоту кишечника у этих людей, можно определить специфический дисбиоз и таким образом оценить вероятность успеха или неудачи коррекционной дие- ты. Лечение многих эмерджентных заболеваний, таких как рак, претерпело аналогичные изменения, и новые направления патофизиологических исследований от- вечают его интересам.
ПИЩЕВОД – ЖЕЛУДОК
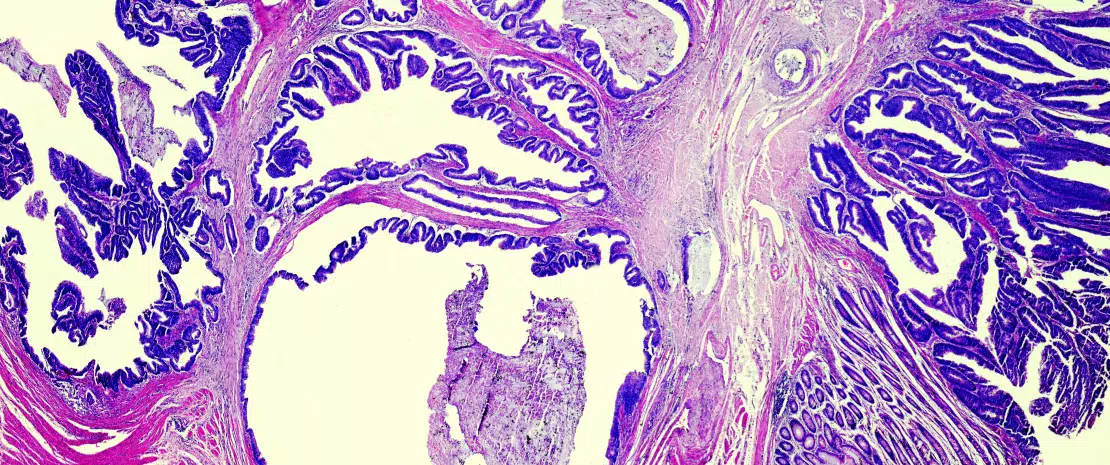
В физиологических условиях микробиота пищевода схожа с микробиотой ротовой полости: обилие бактерий рода Firmicutes, Bacteroidetes, Actinobacteria, Proteobacteria и Fusobacteria с преобладанием бактерий рода Streptococcus в пищеводе. При гастроэзофагеальной рефлюксной болезни (ГЭРБ) и синдроме Барретта (СБ) (состояниях, которые способствуют возникновению предраковых изменений) состав микробиоты пищевода является близким к составу микробиоты желудка, с обилием бактерий рода Bacteroidetes, Proteobacteria и Fusobacterium. Парадоксальным образом Helicobacter pylori (желудочная бактерия, известная как кофактор развития новообразований желудка (рак и лимфома MALT-типа)), по-видимому, выполняет защитную роль относительно аденокарцином пищевода, заболеваемость которыми растет в западных странах. Фактически, помимо H. pylori, к развитию опухолей желудка причастны разные виды бактерий, например Pasteurella stomatis, Dialister pneumosintes, Slakia exigua, Parvimonas micra и Streptococcus anginosus. Согласно недавнему исследованию бактерии Enterobacteriaceae, особенно Ruminococcus, могут играть важную роль в ускользании аденокарцином желудка и пищевода от иммунологического надзора [2].
КОЛОРЕКТАЛЬНЫЙ РАК (КРР) И МОДЕЛЬ УСКОЛЬЗАНИЯ ОПУХОЛИ ОТ ИММУНОЛОГИЧЕСКОГО НАДЗОРА
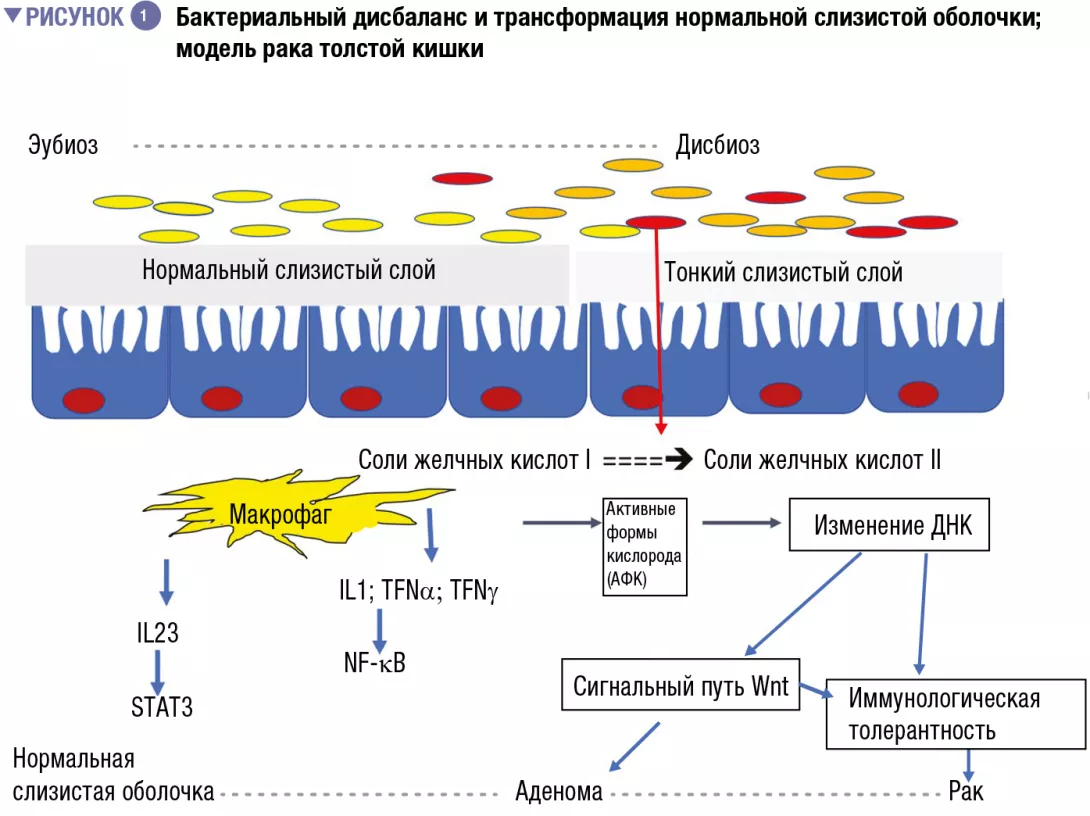
Со времени первых формулировок связи между дисбиозом толстой кишки и КРР [3, 4] гипотеза о том, что флора полости рта участвовала в развитии дисбиоза, причастного к развитию КРР, была обновлена в свете оригинальной работы, касающейся связи между переносом бактерий изо рта в кишечник и дисбио- зом толстой кишки [5]. Нарушение бактериального баланса часто происходит за счет таких полезных видов, как Bifidobacteria и Lactobacilli, которые помогают обеспечивать иммунный ответ [2]. Поскольку эти бактерии больше не могут служить противовесом провоспалительным бактериям, то в слизистой оболочке толстой кишки развивается бессимптомное хроническое воспаление, которое, как известно, способствует процессам канцерогенеза. Известно, что в настоящее время в современной «западной» диете (с высоким содержанием животного белка и сахара) преобладают провоспалительные бактерии в ущерб противовоспалительным бактериям. В противоположность сказанному «средиземноморская» диета (богатая растительной клетчаткой) ограничивает это разрушительное действие [6]. При недостаточном потреблении клетчатки бактерии, развившиеся в результате чрезмерного потребления животного белка и жира, разрушают слизистую оболочку, используя ее в качестве источника клетчатки, и подвергают эпителий кишечника воздействию потенциально вирулентных бактерий (рисунок 1). На клеточном уровне эта диета стимулирует основные биологические сигнальные пути, такие как Wnt и классический путь NF-kB (ядерный фактор каппа-В), соответственно ответственные за обновление клеток и повышенную продукцию провоспалительных цитокинов [6]. Это явление можно сравнить с изменением иммунного ответа в сторону толерантности из-за переизбытка других популяций бактерий, таких как Parvimonas micra и Streptococcus fragilis [7]. У животных бактерии Bacteroides fragilis и Escherichia coli, которые в избытке присутствуют на поздних стадиях КРР (стадии распро- страненности опухолевого процесса TNM III или IV), поддерживают воспалительный процесс в слизистой оболочке толстой кишки и способствуют развитию опухоли [8].
ГЕПАТОЦЕЛЛЮЛЯРНЫЙ РАК (ГЦР)
Первичные опухоли печени развиваются в результате хронического процесса, включая цирроз печени, который сам возникает как осложнение вирусного гепатита В или С. Эпигенетические механизмы, возникающие в результате действия микроорганизмов, приводят к исчезновению некоторых главных генов, таких как p16 (INK4A), глутатион-S-трансфераза P 1 (GSTP1), CDH1 (E-кадгерин), домен Ras, в который входит белок 1 (RASSF1A), p21 (WAF1/CIP1), все из которых гиперметилированы вирусом гепатита В, а также супрессором цитокиновых сигналов 1 (SOCS‑1), и гена STAT1, гиперметилированного вирусом гепатита С. Эти гены противостоят возникновению рака, но гиперметилирование подавляет их экспрессию. Бактерии могут вмешиваться, чтобы способствовать этим процессам: бактерии Helicobacter hepaticus увеличивают риск заболевания раком либо непосредственно активируя пути Wnt и NK-kB, либо содействуя процессу, индуцированному вирусом гепатита С. Некоторые энтеробактерии, такие как E. coli, были идентифицированы в качестве кофакторов активации канцерогенного процесса наряду с факторами влияния окружающей среды (вирусы, химические загрязнители и т. д.). При метаболизме нарушение баланса популяций Firmicutes/Bacteroidetes, известного фактора риска возникновения ожирения, повышает риск развития ГЦР путем вытеснения «защищаю- щих» бактерий, таких как Lactobacillus, Bifidobacterium, Parabacteroides и Oscillibacter [9, 10].
РАК ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
У пациентов с раком поджелудочной железы наблюдается высокая плотность бактерий Enterobacteriaceae, Pseudomonadaceae, Moraxellaceae и Enterococcaceae в опухолевой ткани, в то время как бактерии Acinetobacter, Aquabacterium, Oceanobacillus, Rahnella, Massilia, Delftia, Deinococcus и Sphingobium в большом количестве представлены в полости двенадцатиперстной кишки. Как и при КРР, дисбиоз, связанный с этим раком, также включает изменения флоры полости рта, характеризующиеся переизбытком бактерий Porphyromonas gingivalis и недостаточным количеством бактерий Neisseria elongate или Streptococcus mitis. Еще один пример связи между дисбиозом кишечника и раком ЖКТ. Что касается лечения, важно отметить, что бактерии Gammaproteobacteria могут повышать устойчивость к гемцитабину, стандарту лечения рака поджелудочной железы.
ПРОТИВООПУХОЛЕВЫЙ ИММУННЫЙ ОТВЕТ И ДИСБИОЗ
У аксенических (безмикробных) животных развивается меньше опухолей, вероятно, из-за иммунологической толерантности и меньшей реактивной воспалительной активности, что можно объяснить отсутствием физиологической микробиоты. Микробиота может способствовать развитию рака с помощью разных механизмов: прежде всего, через активацию воспаления при дисбиозе и переориентацию иммунной системы; через продуцирование генотоксинов (колибактин, фрагилизин) и факторов вирулентности бактериями, способными непосредственно изменять ДНК клетки-хозяина; через индукцию окислительного стресса путем продуцирования активных форм кислорода (АФК); и, наконец, через бактериальное продуцирование вторичных метаболитов (вторичных желчных кислот и т. д.). Например, в модели толстой кишки есть четыре разных подтипа, соответствующих различным метаболическим, иммунным и воспалительным путям [11]. В подтипе КРР с инфильтрацией Т-лимфоцитами Т-клетки обладают пониженной способностью экспрессировать цитокины или атаковать клетки-мишени из-за постоянной стимуляции опухолевыми антигенами. Это явление известно как истощение Т-клеток. Это самый распространенный механизм ускользания от иммунологического надзора. Независимо от первоначального набора лимфоцитов – цитотоксических или посредников – опухоль продолжает расти [9]. Регуляторные Т-клетки (Tregs) будут содействовать иммуносупрессивному эффекту, продуцируя такие факторы, как TGF-β. Tregs преимущественно набираются в фазе истощения. Кроме того, внутриопухолевая плотность Tregs является отрицательным прогностическим маркером. Продуцируя иммуносупрессивные цитокины (IL-10 и TGF-β), Tregs препятствуют специфическому действию Т-киллеров, которые обычно нацелены на опухоль. В частности, Tregs усиливают иммунный подавляющий белок CTLA‑4 или CD152 (цитотоксический T-лимфоцит-ассоциированный белок 4) этих Т-клеток. Этот белок стал мишенью для современной иммунотерапии. Tregs действуют с помощью клеток Th17 и STAT3 (передатчик сигнала и активатор транскрипции 3), участвующих в процессе канцерогенеза в различных органах. Клетки Th17 продуцируют провоспалительные цитокины (IL-17 и IL-23), которые способствуют росту опухоли за счет увеличения продуцирования цитокинов Th1 и хемокинового (C-X-C мотива) лиганда 9 и 10 (CXCL9 и CXCL10). Клетки Th17 имеют сходные характеристики со стволовыми клетками и могут самообновляться. Цитокиновая среда в месте образования опухоли влияет на различные модели экспрессии клеток Th17: при колоректальном, гепатоцеллюлярном раке и раке поджелудочной железы инфильтрация опухоли клетками Th17 является неблагоприятным прогностическим маркером, поскольку она способствует иммунологической толерантности к опухоли. Дисбиоз в слизистой оболочке модулирует экспрессию IL17, IL-23, STAT3.
МИКРОБИОТА И ЛЕЧЕНИЕ РАКА
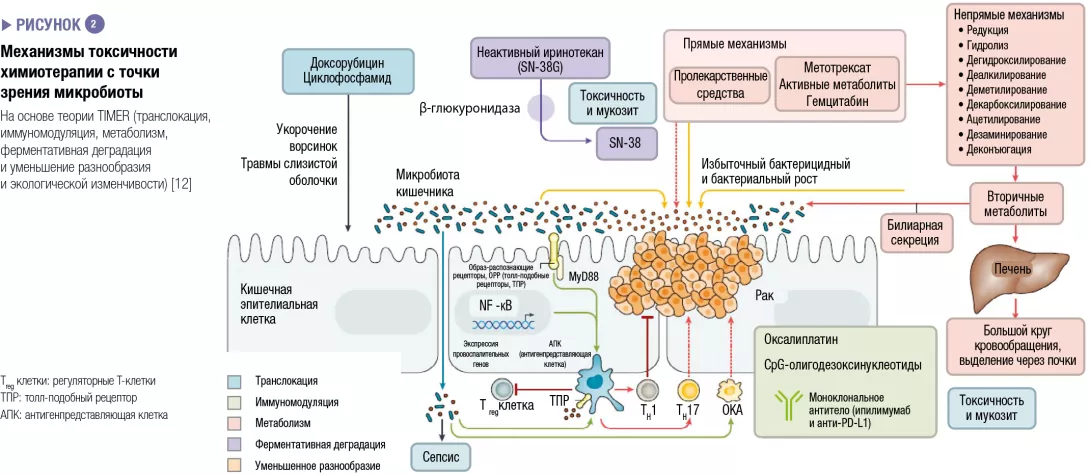
Было продемонстрировано на мышах и у людей, что микробиота кишечника модулирует ответ на противоопухолевую химиотерапию и иммунотерапию. Рак легких и почек, а также меланома были изучены в ходе клинических испытаний. Это действие никогда не обусловливалось одним видом бактерий: оно всегда отражает влияние обитающего в кишечнике микробного сообщества в целом на иммунитет или функцию, выполняемую различными видами бактерий. Эти микробные сообщества влияют на ответ на терапию с точки зрения побочных эффектов/токсичности и устойчивости к лечению (рисунок 2). Например, протеобактерии, в частности, Mycoplasma hyorhinis, обладают цитидиндезаминазной активностью, которая метаболизирует гемцитабин и тем самым снижает его эффективность. Аналогичным образом циклофосфамид обладает различным противоопухолевым действием в зависимости от дозы; его эффективность модулируется грамположительными (включая Enterococcus hirae) и грамотрицательными бактериями (включая Barnesiella intestinihominis) [12]
Противоопухолевая иммунотерапия успешно применяется при злокачественной меланоме. Методы лечения, включающие ингибиторы контрольных точек иммунного ответа, нацеленные на PD-1 и CTLA-4, являются наиболее перспективными. Впервые было отмечено, что у пациентов с метастатическим раком почек или легких применение антибиотиков может модулировать активность анти-PD-1 или анти-PD-L1 иммунотерапии [13]. Впоследствии большое американское исследование метастатической меланомы, которую лечили с помощью иммунотерапии, показало, что хороший ответ на лечение (более длительная выживаемость без прогрессирования заболевания и общая выживаемость) зависел от микробного состава толстой кишки: трансплантация фекальной микробиоты от пациентов к мышам-реципиентам показала, что дисбактериоз кишечника действительно являлся основной причиной вариабельности ответа на анти-PD-1-иммунотерапию [14, 15]. Эти данные необходимо сравнить с данными о полиморфизмах ТПР4, которые связаны с вариабельным ответом на иммунотерапию. ТПР (толл-подобные рецепторы) представляют собой трансмембранные или цитозольные рецепторы, которые принадлежат к большому семейству рецепторов врожденной иммунной системы (ОРР, образ-распознающие рецепторы), экспрессируемые эпителиальными клетками и иммунными клетками в кишечнике. Связывание ТПР с микробным лигандом запускает внутриклеточный сигнальный каскад, который обычно приводит к воспалительной реакции посредством активации NF-kB. Оказалось, что иммунный статус хозяина является основным фактором ответа на все виды птивоопухолевого лечения, полученного напрямую и при изменениях микробиоты кишечника. Следует отметить, что микробиота также влияет на другие терапевтические методы, такие как лучевая терапия и хирургия: ионизирующее излучение менее токсично для аксенических мышей по сравнению с обычными мышами; послеоперационное заживление у больных после хирургического вмешательства по поводу рака толстой кишки зависит от типа дисбиоза.
ЗАКЛЮЧЕНИЕ
Микробный состав толстой кишки зависит от факторов окружающей среды и может влиять на развитие и прогрессирование злокачественных опухолей через метаболический, воспалительный и иммунный механизмы. Проводятся исследования, для того чтобы лучше изучить устойчивость к противоопухолевым препаратам и их токсичность. Вполне вероятно, что модуляция микробиоты кишечника станет способом оптимизации противоопухолевой терапии в будущем.








