Reconstitución de la microbiota intestinal mediante trasplante de microbiota fecal autóloga en pacientes con tratamiento atb
Artículo comentado - Adulto
Por el Pr. Harry Sokol
Gastroenterología y nutrición, Hospital Saint-Antoine, París, Francia
Espacio para el público general
Encuentra aquí tu espacio dedicado
en_sources_title
en_sources_text_start en_sources_text_end
Capítulos

Faecal transplant preparation. A technician storing a prepared sample of human faecal matter in cold storage.
Acerca de este artículo
Autor
Comentario al artículo original de Taur et al. (Science Translational Medicine 2018 [1])
Un tratamiento antibiótico puede afectar la población de bacterias comensales de la microbiota intestinal del paciente y, paradójicamente, aumentar el riesgo de infecciones posteriores. En el alotrasplante de células madre hematopoyéticas (alo- CMH), la administración de antibióticos es crucial para obtener resultados clínicos óptimos, pero perturba considerablemente la diversidad de la microbiota intestinal, causando la pérdida de numerosos microrganismos beneficiosos. A pesar de que la pérdida de diversidad de la microbiota intestinal durante el alo-CMH se asocia a una mayor mortalidad, aún no se han desarrollado métodos que consigan restablecer las bacterias comensales diezmadas. Se ha iniciado un ensayo clínico controlado y aleatorizado, para comparar el trasplante de microbiota fecal autólogo (auto-TMF) con la ausencia de esta intervención; se analizaron los perfiles de microbiota intestinal de 25 pacientes tratados con alo-CMH (14 que recibieron un auto-TMF y 11 pacientes control que no recibieron este tratamiento). Los cambios en la diversidad y la composición de la microbiota intestinal revelaron que el auto-TMF había estimulado la diversidad microbiana y restablecido la composición de la microbiota intestinal que el paciente tenía antes del tratamiento antibiótico y del alo-CMH. En el contexto de un alo-CMH, estos resultados muestran la utilidad potencial de conservar muestras de heces con vistas a un auto-TMF para restablecer la microbiota intestinal en pacientes a los que se haya administrado un tratamiento antibiótico intenso.
¿Qué sabemos sobre este tema?
Los tratamientos antibióticos dañan la microbiota intestinal y aumentan el riesgo de infecciones gastrointestinales. A pesar de que este efecto está reconocido desde hace más de 60 años, la corrección de las alteraciones de la microbiota intestinal inducidas por los antibióticos aun no es una práctica clínica estándar. A los pacientes que han recibido un injerto alogénico de células madre hematopoyéticas (alo-CMH), se les administran antibióticos sistemáticamente para tratar o reducir el riesgo de infección grave. Existen estudios prospectivos en pacientes que han recibido un alo-CMH que han demostrado que la microbiota intestinal se altera claramente durante el tratamiento, con importantes pérdidas de bacterias anaerobias obligatorias, incluidas especies inmunomoduladoras como las pertenecientes a la clase Clostridia y al filo Bacteroidetes [2]. Las consecuencias clínicas de estas alteraciones también son visibles en un alo- CMH: las perturbaciones de las bacterias anaerobias obligatorias beneficiosas están correlacionadas con las complicaciones que incluyen las infecciones sistémicas por Enterococo Resistente a la Vancomicina (ERV), las infecciones por Clostridium difficile, y la enfermedad del injerto contra el huésped (GVHD) [2, 3]. En su conjunto, los pacientes que pierden la diversidad de su microbiota intestinal en el momento del trasplante de células madre hematopoyéticas tienen niveles más elevados de mortalidad relacionada con el injerto [4].
¿Cuáles son los principales resultados que aporta este estudio?
Los pacientes que reciben un alo-CMH se quedan inmunodeprimidos varios meses después del trasplante, y aunque pacientes inmunodeprimidos, incluidos los tratados con alo-CMH, hayan sido tratados sin efectos secundarios con un TMF heterólogo [5], los autores han considerado que un TMF autólogo sería más seguro, en concreto porque su naturaleza podría minimizar en el paciente el riesgo de exposición a microorganismos potencialmente patógenos aún sin detectar. Los autores han iniciado un ensayo clínico controlado aleatorizado con el objetivo de determinar la viabilidad del auto-TMF para restaurar la microbiota intestinal y para disminuir las complicaciones relacionadas con el alo- CMH. Aquí, presentan un análisis de las modificaciones de la composición de la microbiota intestinal en 25 pacientes aleatorizados en este estudio y de los cuales se recogieron muestras de heces longitudinalmente.
En primer lugar, los autores confirmaron en su grupo de 753 pacientes (con 3 237 muestras fecales recogidas longitudinalmente) que el alo-CMH y los diferentes tratamientos antibióticos asociados, inducían una disminución neta de la diversidad de la microbiota intestinal con un nivel mínimo 5 días después del alo-CMH, una persistencia de las alteraciones durante al menos 6 semanas y una ausencia de recuperación en la mayoría de los pacientes 100 días tras el alo-CMH.
PUNTOS CLAVE
-
La microbiota intestinal se ve fuertemente perturbada durante el tratamiento por alo-CMH, y estas perturbaciones podrían desempeñar una función en las complicaciones asociadas
-
El auto-TMF es una estrategia viable y eficaz en la reconstitución de la microbiota después de las perturbaciones inducidas por el alo-CMH
-
Falta evaluar las consecuencias de la reconstitución de la microbiota en términos de pronóstico hematológico
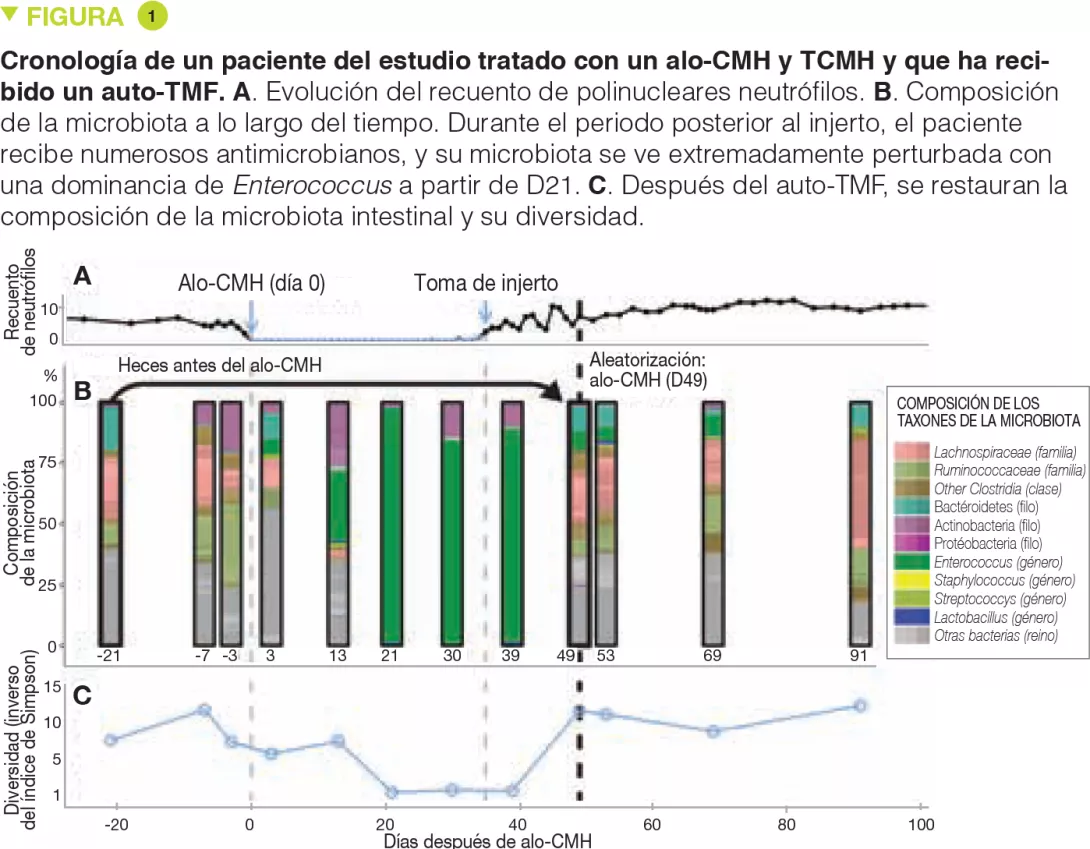
En el marco del estudio aleatorizado, las muestras de heces de los pacientes tomadas antes del alo-CMH se congelaron a -80 ºC y fueron conservados. De una a cinco semanas (13 días de media) después del alo-CMH, en el momento de la administración del injerto (definida por la recuperación de los polinucleares neutrófilos por encima de 500/mm3), se reevaluó a los pacientes, y se tomó otra muestra de heces. Si se observaba una disminución de las bacterias pertenecientes al filo de las Bacteroidetes, se aleatorizaba a los pacientes. Se presenta el resultado de los análisis de la microbiota de los 25 primeros pacientes evaluables (14 del grupo auto- TMF y 11 del grupo control. El auto-TMF se realizaba mediante un lavado único, después de una preparación cólica con polietilenglicol, similar a la preparación que se realiza antes de una colonoscopia. Los autores han demostrado que el auto-TMF permite restaurar no solo la diversidad de la microbiota intestinal, sino también su composición anterior al alo-CMH.
¿Cuáles son las consecuencias en la práctica?
Varios estudios muestran que la microbiota intestinal y sus perturbaciones podrían desempeñar una función en la aparición de las complicaciones infecciosas y no infecciosas habituales durante el alo-CMH. Este primer estudio demuestra que la recogida y conservación de heces del paciente antes de un alo-CMH para readministrarlas una vez administrado el injerto es una estrategia factible y eficaz para la reconstitución de la microbiota. Ahora falta saber si los pacientes que han recibido un auto-TMF tienen un mejor pronóstico frente a estas complicaciones y una mayor tasa de supervivencia global. Si se confirma la eficacia de esta estrategia, también podría considerarse para otras situaciones en las que se esperan perturbaciones importantes de la microbiota, como un tratamiento antibiótico amplio y prolongado u otras quimioterapias anticancerígenas.
Conclusión
Aunque todavía se deban valorar los beneficios en términos de pronóstico hematológico y de supervivencia global, el auto-TMF es una opción estratégica prometedora para reconstituir la microbiota intestinal después de las perturbaciones inducidas por el tratamiento antibiótico asociado con el alo-CMH.





