Restablecimiento de la microbiota intestinal en adultos con buena salud tras la exposición a un antibiótico
Artículo comentado - Adulto
Por el Pr. Harry Sokol
Gastroenterología y nutrición, Hospital Saint-Antoine, París, Francia
Espacio para el público general
Encuentra aquí tu espacio dedicado
en_sources_title
en_sources_text_start en_sources_text_end
Capítulos

Acerca de este artículo
Autor
Comentario al artículo original de Palleja et al. (Nature Microbiol 2018)
Para minimizar el impacto de los antibióticos, los microorganismos intestinales tienen e intercambian genes de resistencia a los antibióticos, y este conjunto recibe el nombre de resistoma. Utilizando un método de secuenciación metagenómica shotgun, los autores analizaron la erradicación parcial de la microbiota intestinal y su recuperación en 12 hombres sanos durante un período de 6 meses tras una intervención de 4 días con un cóctel de 3 antibióticos de último recurso: meropenem, gentamicina y vancomicina. Los cambios iniciales consistieron en la proliferación de enterobacterias y otros patobiontes, como Enterococcus faecalis y Fusobacterium nucleatum, y la desaparición de bacterias del genéro Bifidobacterium así como las productoras de butiratos. La microbiota intestinal de los sujetos estudiados retornó a un estado cercano al inicial en 1,5 meses, aunque 9 especies, que estaban presentes en todos los sujetos antes del tratamiento, permanecieron indetectables en la mayoría de los sujetos después de 180 días. Las especies portadoras de genes de resistencia a β-lactaminas fueron seleccionadas positivamente durante y después de la intervención. La presencia de genes de resistencia a los glicopéptidos o aminoglucósidos aumentó las posibilidades de colonización de novo. Los cambios en la composición de la microbiota inducida por una intervención antibiótica in vivo fueron coincidentes con los resultados obtenidos en los ensayos in vitro. A pesar de un pequeño pero duradero efecto después de la exposición a los antibióticos, la microbiota intestinal de los adultos jóvenes sanos se recupera tras una intervención antibiótica de amplio espectro a corto plazo, y la presencia de genes de resistencia a los antibióticos modula el proceso de recuperación.
¿Qué sabemos sobre este tema?
La microbiota intestinal humana forma un ecosistema complejo y equilibrado. Las perturbaciones de este ecosistema pueden desempeñar un papel en la aparición de infecciones, de obesidad, de diabetes y de patologías inflamatorias y neurológicas. Se estima que se puede atribuir a los antibióticos un aumento de la esperanza de vida de 2 a 10 años. Sin embargo, la exposición precoz a los antibióticos también ha sido asociada a efectos metabólicos, inflamatorios y neurológicos nocivos, tanto en modelos con animales como en humanos. Cuando las comunidades microbianas se exponen a antibióticos, reaccionan no solo modificando su composición, sino también evolucionando, optimizando y difundiendo los genes de resistencia a los antibióticos (GRA), formando colectivamente el resistoma [2]. La microbiota intestinal humana se considera un reservorio para los GRA, donde sus miembros intercambian estos genes, y propagan así la resistencia [3]. El desarrollo y la difusión de la resistencia microbiana a los antibióticos es un grave problema de salud pública. Solo algunos estudios han estudiado los efectos de antibióticos particulares en los ecosistemas intestinales frente a los resistomas asociados. Varios estudios previos han demostrado que la administración de antibióticos inducía a una disminución de la diversidad y a un aumento de la transferencia de GRA [4, 5]. Sin embargo, aún no se han estudiado los efectos de una combinación de antibióticos sobre la microbiota y la función de los GRA en la persistencia microbiana intestinal. En el presente estudio, 12 hombres con buena salud (de entre 18 y 40 años de edad) recibieron un cóctel de antibióticos de último recurso (vancomicina, gentamicina y meropenem), y los autores estudiaron los efectos sobre la microbiota intestinal utilizando un enfoque por secuenciación shotgun sobre muestras fecales extraídas previamente y en cuatro momentos diferentes durante un periodo de seis meses después del tratamiento.
Los antibióticos, elemento clave del arsenal terapéutico moderno, han salvado millones de vidas. Sin embargo, su uso excesivo y a veces inadecuado puede conducir a la aparición de distintas formas de resistencia en los microorganismos. Cada año, la Organización Mundial de la Salud (OMS) organiza la Semana mundial de concienciación sobre la RAM (WAAW) para sensibilizar a la población sobre este problema de salud pública. Lea la página dedicada a este asunto.
Resistencia a antibioticos: la microbiota en primer plano
¿Qué es la Semana mundial de concienciación sobre la RAM?
Desde 2015, la OMS organiza cada año la Semana mundial de concienciación sobre la RAM (WAAW), cuyo objetivo es sensibilizar al público sobre la resistencia mundial a los antimicrobianos. Esta campaña, que tendrá lugar del 18 al 24 de noviembre, alienta al público general, a los profesionales sanitarios y a los responsables a hacer un uso razonable de los antimicrobianos para evitar el desarrollo de resistencia a los antimicrobianos.
¿Cuáles son los principales resultados que aporta este estudio?
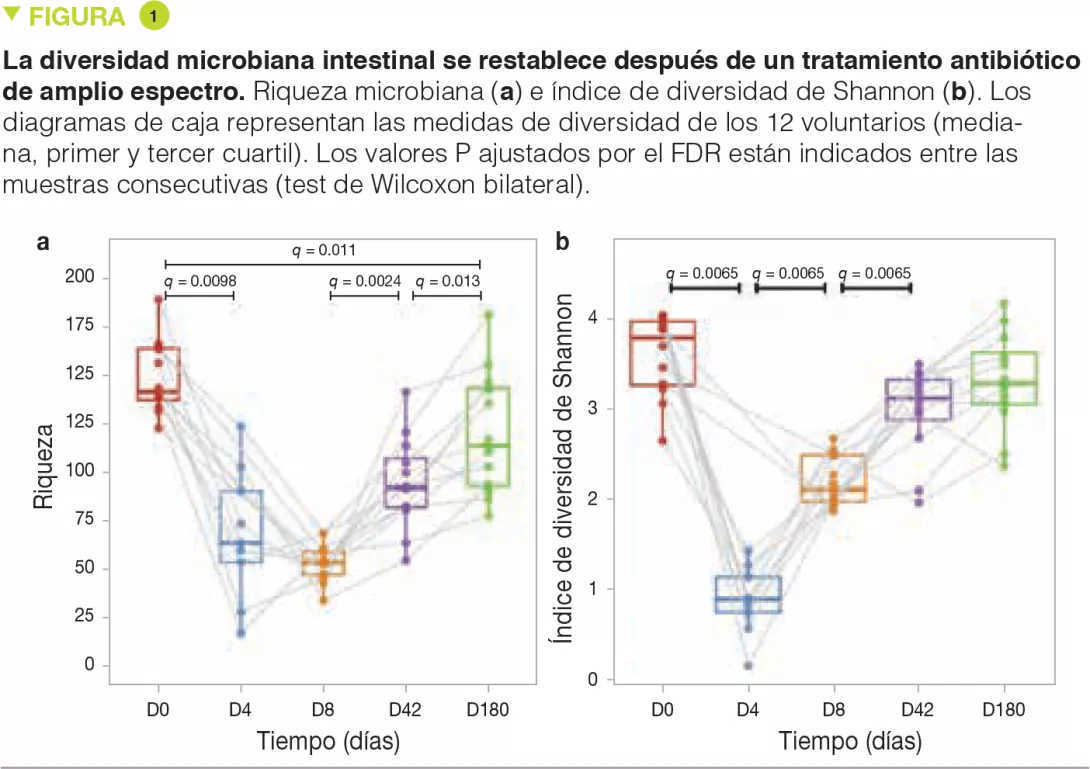
En D4, poco después de la intervención, la riqueza y la diversidad de la microbiota se habían reducido considerablemente respecto a D0. Sin embargo, a pesar del muy amplio espectro del tratamiento antibiótico utilizado, seguía habiendo numerosas especies detectables en D4 (Figura 1a). Desde D8, la diversidad (medida por el índice de Shannon) había aumentado considerablemente, sugiriendo que los microrganismos supervivientes habían comenzado a regenerarse (Figura 1b). La diversidad había regresado casi completamente al estado inicial a los 6 meses, pero no así la riqueza, lo que sugería que ciertas cepas habían sido eliminadas de manera definitiva (o por lo menos de forma prolongada).
Entre los cambios precoces observados, había un enriquecimiento de comensales habitualmente subdominantes como Escherichia coli, Veillonella spp., Klebsiella spp., Enterococcus faecalis y Fusobacterium nucleatum y una mayor disminución de bacterias productoras de butirato como Faecalibacterium prausnitzii, Roseburia hominis, Anaerostipes hadrus, Coprococcus spp. y Eubacterium spp. Estas alteraciones de composición ya no eran significativas a partir de D42.
Los autores investigaron a continuación la función de los GRA en la evolución de la microbiota de los sujetos analizados. En concreto, observaron que las especies metagenómicas portadoras de β-lac- tamasas tenían posibilidades de supervivencia significativamente más elevadas (OR = 1,64 [1,24-2,17]) en D8. Por otro lado, las especies metagenómicas no detectadas en D0 tenían más posibilidades de colonización de novo en un punto posterior si eran portadoras de GRA frente a una de las tres clases utilizadas.
Puntos clave
-
La microbiota intestinal de jóvenes adultos con buena salud es recuperable a los cuatro días tras un tratamiento antibiótico de amplio espectro con un restablecimiento en aproximadamente 6 meses de la mayor parte de las comunidades bacterianas.
-
La recuperación individual de las especies está modulada por la presencia de GRA.
-
Aún está por estudiar el efecto de los tratamientos antibióticos prolongados o repetitivos, particularmente en la población pediátrica.
¿Cuáles son las consecuencias en la práctica?
Estos resultados demuestran que la microbiota intestinal de jóvenes adultos con buena salud es resistente tras cuatro días de tratamiento antibiótico de amplio espectro, con una recuperación de la mayor parte de las comunidades bacterianas en aproximadamente 6 meses. La recuperación individual de las especies está modulada por la presencia de GRA. Son necesarios otros estudios para evaluar, por un lado, el efecto de perturbaciones repetitivas y/o en periodos más prolongados y, por otro, si estos resultados también son válidos en niños, que tiene una microbiota y un sistema inmunitario inmaduros. Es posible que la utilización repetitiva de antibióticos durante periodos prolongados seleccione bacterias portadoras de GRA en detrimento de otras bacterias comensales, con efectos prolongados o permanentes sobre la microbiota. En ese sentido, se podrían plantear intervenciones correctivas consistentes en una aportación exógena de microrganismos. Por tanto, los efectos de los antibióticos sobre la microbiota son importantes y su uso debe estar justificado.
Conclusión
Los antibióticos de amplio espectro impactan negativamente en la microbiota intestinal de manera inmediata, significativa y duradera para ciertas especies. En los jóvenes adultos con buena salud, la microbiota intestinal es recuperable pero un restablecimiento casi completo necesita alrededor de 6 meses. La capacidad de regeneración de las especies, modulada por la transferencia de GRA, es más favorable a la diversidad que a la riqueza.






