Восстановление здоровой микробиоты кишечника взрослого человека после воздействия антибиотиков
Комментарии к статье — Раздел, посвященный взрослым
Проф. Гарри Сокол (Harry Sokol)
Отделение гастроэнтерологии и нутрициологии, больница Сен-Антуан, Париж, Франция
Раздел для широкой публики
Найдите здесь свое выделенное место
en_sources_title
en_sources_text_start en_sources_text_end
Делиться - значит заботиться
Возможно, эта тема заинтересует ваших коллег. Почему бы не поделиться ею?
Разделы

Об этой статье
Автор
Комментарии к оригинальной статье Palleja и соавт. (Nature Microbiology 2018)
Чтобы максимально защититься от антибиотиков, кишечные микроорганизмы накапливают и обмениваются генами антибиотикорезистентности, которые в совокупности называют резистомом. Используя метод дробовика, мы в течение 6 месяцев анализировали изменения метагенома при частичной эрадикации и последующем возобновлении роста микробиоты кишечника у 12 здоровых мужчин, которые в течение 4 дней принимали «коктейль» из 3 антибиотиков последней инстанции: меропенема, гентамицина и ванкомицина. Первые изменения включали бурный рост энтеробактерий и других патобионтов, таких как Enterococcus faecalis и Fusobacterium nucleatum, а также истощение видов Bifidobacterium и продуцентов бутирата. В течение полутора месяцев кишечная микробиота восстанавливалась до почти исходного состава, однако 9 распространенных видов, которые присутствовали у всех участников до начала эксперимента, у большинства из них не обнаруживались даже через 180 дней. Виды, несущие гены резистентности к β-лактамам, получили селективное преимущество во время и после вмешательства. Накопление генов резистентности к гликопептидам или аминогликозидам увеличивало шансы на колонизацию, но, в случае первых, снижало шансы на выживание. Изменения состава микробиоты под действием антибиотиков in vivo коррелировали с результатами тестов на антибиотикочувствительность in vitro. Несмотря на относительно легкие, но длительные последствия антибиотикотерапии, микробиота кишечника здоровых молодых людей устойчива к краткосрочному воздействию антибиотиков широкого спектра действия, а перенос генов резистентности к антибиотикам влияет на процессы ее восстановления.[1]
Что мы уже знаем?
Микробиота кишечника человека образует сложную и сбалансированную экосистему. Нарушения этой экосистемы могут играть роль в развитии инфекций, ожирения, сахарного диабета, а также неврологических и воспалительных заболеваний. Антибиотики добавили от 2 до 10 лет к ожидаемой продолжительности жизни, но воздействие этих препаратов в раннем возрасте связано с неблагоприятными метаболическими, воспалительными и неврологическими эффектами как у животных, так и у человека. Когда микробные сообщества подвергаются воздействию антибиотиков, они не только реагируют, изменяя свой состав, но и эволюционируют, оптимизируя и распространяя гены устойчивости к антибиотикам (гены ABR), в совокупности образующие резистом.[2] Микробиота кишечника человека является резервуаром генов ABR, которые обмениваются между резидентными штаммами, распространяя устойчивость.[3] Появление и распространение антибиотикорезистентных бактерий представляет серьезную угрозу для общественного здравоохранения. Только в нескольких исследованиях изучали влияние конкретных антибиотиков на кишечные экосистемы и связанные с ними резистомы. Показано, что применение антибиотиков вызывает уменьшение разнообразия микробиоты и увеличение носительства генов ABR.[4, 5] Однако влияние комбинации антибиотиков на микробиоту и роль генов ABR в микробной персистенции еще не изучены. В этом исследовании 12 здоровых мужчин в возрасте от 18 до 40 лет получали коктейль из трех антибиотиков последней инстанции (ванкомицин, гентамицин и меропенем). Авторы проанализировали влияние такого «лечения» на микробиоту кишечника путем секвенирования образцов кала, взятых до и в четыре временных точки на протяжении 6-месячного периода после приема антибиотиков.
Будучи одними из важнейших препаратов в современном терапевтическом арсенале, антибиотики спасают миллионы жизней. С другой стороны, чрезмерное использование антибиотиков может привести к возникновению множественных форм резистентности. Каждый год Всемирная организация здравоохранения (ВОЗ) организует Всемирную неделю правильного использования противомикробных препаратов (WAAW) с целью повышения осведомленности об этой проблеме здравоохранения. Читать специальную страницу:
Что такое Всемирная неделя правильного использования противомикробных препаратов?
Каждый год с 2015 г. ВОЗ организует Всемирную неделю правильного использования противомикробных препаратов (WAAW) с целью повышения осведомленности о глобальной проблеме устойчивости к антимикробным препаратам. Эта кампания (проводимая 18-24 ноября) призывает широкую общественность, медицинских работников и ответственных лиц к умеренному использованию антимикробных препаратов, чтобы предотвратить дальнейшее формирование резистентности к противомикробным препаратам.
Каковы основные результаты исследования?
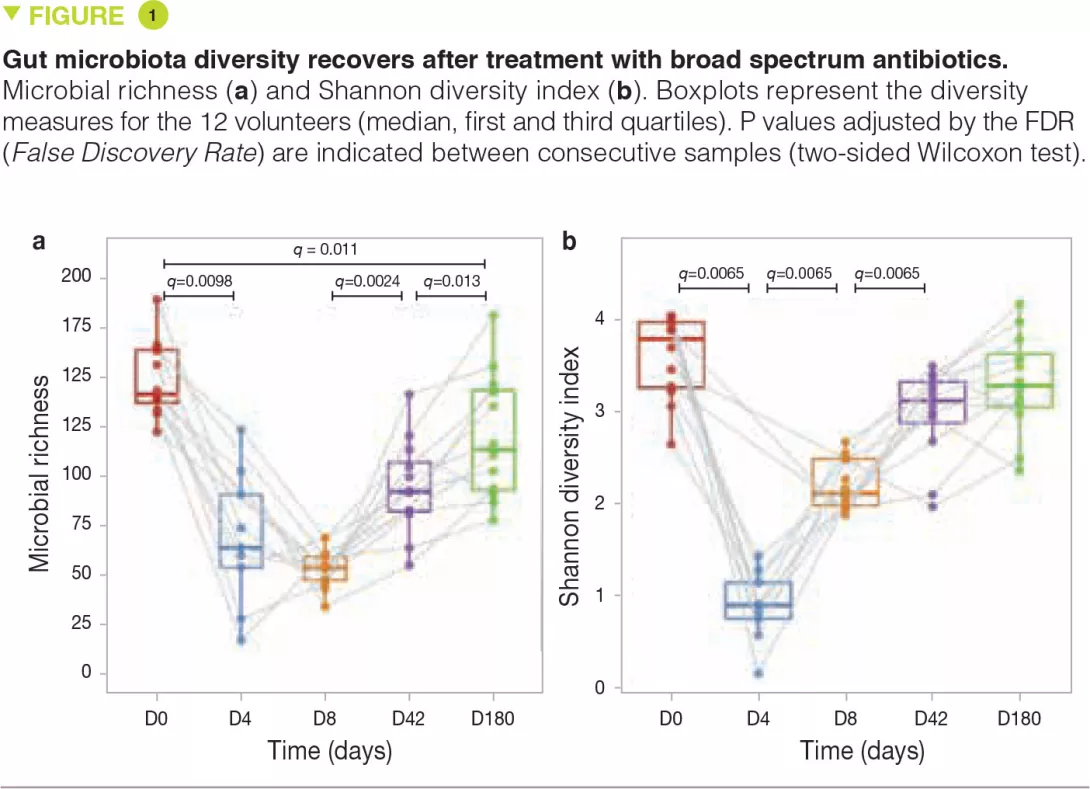
На 4-й день после вмешательства разнообразие и богатство микробиоты заметно снизились по сравнению с исходным уровнем. Однако, несмотря на воздействие антибиотиков очень широкого спектра действия, многие виды все еще обнаруживались на 4-й день (рисунок 1a). На 8-й день разнообразие микробиоты (измеренное по индексу Шеннона) значительно увеличилось, свидетельствуя о начале восстановления сохранившихся микроорганизмов (рисунок 1b). Через 6 месяцев разнообразие микробиоты почти полностью восстановилось до исходного уровня, но это не относилось к богатству, указывая на то, что некоторые штаммы были полностью (или, по крайней мере, в течение длительного времени) уничтожены.
Некоторые ранние изменения включали бурный рост обычно субдоминантных комменсалов, таких как Escherichia coli, Veillonella spp., Klebsiella spp., Enterococcus faecalis и Fusobacterium nucleatum, а также резкое истощение продуцентов бутирата, таких как Faecalibacterium prausnitzii, Roseburia hominis, Anaerostipes hadrus, Coprococcus spp. и Eubacterium spp. Эти сдвиги в составе микробиоты уже не были значимыми на 42-й день.
Затем авторы изучили роль генов ABR в восстановлении микробиоты. В частности, они обнаружили, что метагеномные виды, несущие β-лактамазы, имели значимо более высокие шансы на выживание (ОШ = 1,64 [1,24-2,17]) на 8-й день. Кроме того, метагеномные виды, не выявляемые на исходном уровне, имели лучшие шансы на последующую колонизацию de novo, если несли гены ABR против одного из трех используемых классов антибиотиков.
Ключевые моменты
- Микробиота кишечника здоровых молодых людей устойчива к 4-дневному курсу антибиотиков широкого спектра действия, однако на восстановление большинства микробных сообществ требуется около 6 месяцев.
- Восстановление отдельных видов модулируется переносом генов ABR.
- Влияние продолжительной или повторяющейся антибиотикотерапии требует дальнейшего изучения, особенно у детей.
Что все это значит на практике?
Эти данные показывают, что микробиота кишечника здоровых молодых людей устойчива к 4-дневному курсу антибиотиков широкого спектра действия, однако на восстановление большинства микробных сообществ требуется около 6 месяцев. Восстановление отдельных видов модулируется переносом генов ABR. Необходимы дальнейшие исследования для оценки влияния повторяющейся и/или продолжительной антибиотикотерапии, в том числе у детей с незрелой иммунной системой и микробиотой. Возможно, что повторное использование антибиотиков в течение длительного времени приводит к отбору бактерий, несущих гены ABR, за счет других комменсалов, что может оказывать длительное или постоянное воздействие на микробиоту. В таких случаях может оказаться полезным корректирующее вмешательство с введением экзогенных микроорганизмов. Антибиотики оказывают значимое влияние на кишечную микробиоту, поэтому их следует использовать рационально.
Заключение
Антибиотики широкого спектра действия негативно влияют на микробиоту кишечника, что выражается в немедленных, выраженных и стойких последствиях для некоторых видов. У здоровых молодых людей микробиота кишечника устойчива, но почти полное восстановление занимает около шести месяцев. Способность видов к регенерации, модулируемая переносом генов ABR, более заметна с точки зрения разнообразия, чем богатства.











