Основные новости 54-го конгресса ESPGHAN
ОБЗОР КОНГРЕССА
Проф. Коэн Хьюсентруйт (Koen Huysentruyt)
Отделение детской гастроэнтерологии, гепатологии и нутрициологии, Детский центр кишечной реабилитации (BCIRC), Брюссель, Бельгия
Раздел для широкой публики
Найдите здесь свое выделенное место
en_sources_title
en_sources_text_start en_sources_text_end
Делиться - значит заботиться
Возможно, эта тема заинтересует ваших коллег. Почему бы не поделиться ею?
Разделы

Об этой статье
54-й ежегодный конгресс ESPGHAN прошел с 22 по 25 июня 2022 года в Копенгагене. Это была первая очная встреча после двух лет ограничений из-за пандемии Covid. Специалисты в области детской гастроэнтерологии, гепатологии и питания со всего мира обменялись знаниями, представили результаты исследований и обсудили новые интересные идеи. В этой статье собраны некоторые ключевые темы, касающиеся микробиома.
ВИРОМ
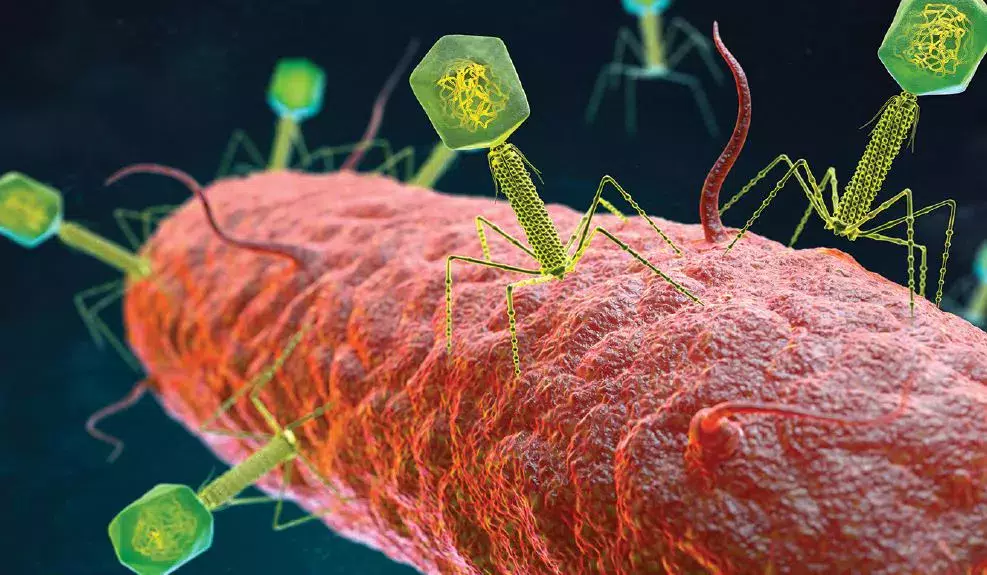
Проф. Деннис Сандрис Нильсен (Dennis Sandris Nielsen) познакомил слушателей с понятием виром, которое включает в себя все вирусы, содержащихся в нашем организме. Это новая область исследований, которая может сыграть важную роль в понимании здоровья и болезней человека. Результаты анализов показывают, что приблизительно 6% ДНК, обнаруживаемой в фекалиях, имеет вирусное происхождение. Все бактерии в организме человека имеют сопутствующие им вирусы. Подобно микробиому, на виром влияют пре-, пери- и постнатальные факторы, такие как питание, окружающая среда, наличие братьев и сестер, прием лекарственных препаратов. Вирусы всегда присутствуют в кишечнике и играют ключевую роль в регуляции его микробиома. Проф. Коэн Хьюсентруйт (Koen Huysentruyt) Отделение детской гастроэнтерологии, гепатологии и нутрициологии, Детский центр кишечной реабилитации (BCIRC), Брюссель, БельгияБактериофаги представляют собой разновидность вирусов, которые способны точечно уничтожать только болезнетворные бактерии. Описаны два различных типа взаимодействий: уничтожение бактериальной клетки и интеграция с клеткой. В первом случае бактериофаги атакуют бактерии, вводят в них свою ДНК и используют бактерии в качестве «цеха» для создания новых фаговых частиц, которые выходят наружу после разрушения клетки.Эти две группы организмов тесно взаимодействуют в рамках таких процессов, как поддержание динамического разнообразия популяций, борьба за ресурсы, уничтожение конкурентов, фаговый шунт и бактериальная эволюция в контексте увеличения вариабельности фаговых рецепторов. Во втором случае вирус интегрирует свою ДНК в геном бактерии, изменяя ее в полезную для бактериофага сторону. В исследовании образцов кала здоровых младенцев, проведенном в Дании, было выявлено более 10 000 вирусных видов из 248 семейств. Примечательно, что 232 из них были открыты впервые — это подтверждает гипотезу о том, что мы еще очень мало знаем о вирусах в нашем организме [1]. Возникает вопрос: какое влияние они оказывают на здоровье человека и созревание иммунной системы? Нарушение вирусного баланса в кишечнике может способствовать развитию заболеваний (например, воспалительные заболевания кишечника, некротизирующий энтероколит и т. д.).
КЕСАРЕВО СЕЧЕНИЕ И МИКРОБИОМ
Способ родоразрешения играет ключевую роль в раннем формировании микробиома кишечника. Дети, появившиеся на свет естественным путем (вагинально), и дети, родившиеся с помощью кесарева сечения, подвергаются воздействию разных бактериальных штаммов, что приводит к формированию различной микробиоты. Кроме того, часто причиной кесарева сечения являются различные осложнения со стороны плода. Такие дети чаще имеют низкий рН пуповинной крови, что ведет к снижению клеточной проницаемости, способствуя развитию дисбиоза.
Грудное вскармливание, по-видимому, смягчает вредное влияние кесарева сечения на микробиоту и продолжает оставаться золотым стандартом в питании младенцев. Однако стоит отметить, что женщины, родившие с помощью кесарева сечения, реже кормят грудью или позже начинают грудное вскармливание, вначале прибегая к кормлению ребенка смесью. По этой причине ученые непрерывно ищут идеальное сочетание пре-, про-, син- или постбиотиков для восполнения микробиома кишечника грудных детей.
Д-р Эдуардо Лопес-Уэртас (Eduardo López- Huertas) рассказал о штамме Lactobacillus fermentum и представил многообещающие результаты его применения у младенцев, родившихся путем кесарева сечения. В рандомизированном контролируемом исследовании были проанализировали образцы кала младенцев, которых кормили симбиотической смесью, содержащей L. fermentum и GOS, и обнаружили значительное сходство с образцами кала младенцев, получавших грудное молоко (более высокое содержание бифидобактерий, меньший pH кала) [2]. Также в недавнем метаанализе (3 исследования) было показано, что L. fermentum снижает частоту желудочно- кишечных инфекций на 73% у грудных детей, рожденных путем кесарева сечения. Необходимо больше исследований профилактики заболеваний, в первую очередь инфекций желудочно-кишечного тракта и дыхательных путей, особенно у детей, родившихся с помощью кесарева сечения, у которых имеются проблемы с микробиомом кишечника [3].
ОЛИГОСАХАРИДЫ ЧЕЛОВЕЧЕСКОГО МОЛОКА В ДЕТСКОЙ СМЕСИ И МИКРОБИОМ
Доктор Джайлз Мэйджор (Giles Major) рассказал участникам конгресса о связи между гликанами и кишечным микробиомом. Гликаны или олигосахариды человеческого молока (ОЧМ) влияют на общий состав микробиома кишечника. Грудное молоко содержит множество различных ОЧМ, которые варьируют по концентрации в зависимости от этнической принадлежности матери и периода роста ребенка. При изучении микробиома кишечника в раннем возрасте мы замети липреобладание бифидобактерий у детей на грудном вскармливании по сравнению с теми, кто получал смесь. Эти бифидобактерии важны, так как они поглощают соединения углерода и производят короткоцепочечные жирные кислоты, модулирующие проницаемость кишечного барьера. Их источником углерода являются ОЧМ, которые микробиом расщепляет с помощью специальных ферментов под названием углеводно- активные ферменты (CAZymes). Таким образом, спектр продуцируемых углеводно- активные ферментов будет определять, какие гликаны ребенок может переварить, а тип гликанов, которые ребенок получает с пищей, будет направлять созревание микробиома на ранних этапах жизни.
В настоящее время проводится РКИ, где контрольную группу младенцев на грудном вскармливании сравнивают с детьми, получающими смесь 5-HMO-Blend. Уже есть первые результаты, которые показывают значимые различия в общем микробном разнообразии кишечника между контрольной и исследуемой группами, при этом состав микробиоты в исследуемой группе был схож с таковым у младенцев, находящихся на грудном вскармливании. Докладчик предположил, что это может быть связано с усилением роста бифидобактерий, однако исследованиями это предположение пока не подтверждено.