Иммуннорегулирующие эффекты разнообразия грибковых штаммов при воспалительных заболеваниях кишечника
КОММЕНТАРИИ К СТАТЬЕ - РАЗДЕЛ, ПОСВЯЩЕННЫЙ ВЗРОСЛЫМ
Проф. Гарри Сокол (Harry Sokol)
Отделение гастроэнтерологии и нутрициологии, Больница Сен-Антуан, Париж, Франция
Раздел для широкой публики
Найдите здесь свое выделенное место
en_sources_title
en_sources_text_start en_sources_text_end
Делиться - значит заботиться
Возможно, эта тема заинтересует ваших коллег. Почему бы не поделиться ею?
Разделы

Об этой статье
Автор
Комментарии к статье et al. Nature 2022 [1]
Грибковая микробиота (микобиота) — неотъемлемая часть сложного микробного сообщества, колонизирующего желудочно-кишечный тракт млекопитающих. Она играет важную роль в регуляции иммунной системы. Хотя изменения в микобиоте были связаны с рядом болезней, в том числе воспалительными заболеваниями кишечника (ВЗК), неизвестно, можно ли считать грибковые виды, идентифицированные путем секвенирования, живыми организмами. Также неизвестно, влияют ли конкретные грибы на развитие ВЗК. Авторы разработали трансляционную платформу для функционального анализа микобиома. Сочетая секвенирование микобиоты с помощью метода с высокой разрешающей способностью, культуромику и геномику грибов, систему редактирования штаммов грибов на основе CRISPR-Cas9, функциональные анализы иммунореактивности in vitro и модели in vivo, эта платформа позволяет исследовать перекрестные связи между организмом человека и его кишечной микобиотой. Мы обнаружили богатое генетическое разнообразие оппортунистических штаммов Candida albicans, которые доминируют в слизистой оболочке толстой кишки у пациентов с ВЗК. Среди этих изолятов штаммы с высокой способностью повреждать иммунные клетки (HD-штаммы) отражают особенности течения заболевания у пациентов с язвенным колитом и способны усугублять воспаление в кишечнике in vivo через ИЛ-1β-зависимые механизмы. Воспалительные и противогрибковые ответы со стороны Т-хелперных клеток, продуцирующих интерлейкин-17A (Th17-клетки), индуцированные HD-штаммами в кишечнике, зависели от кандидализина — пептидного токсина, секретируемого C. albicans во время перехода из доброкачественного комменсального в патобионтное состояние. Эти результаты указывают на штаммоспецифический характер взаимодействий между организмом и микобиотой кишечника у человека и позволяют наметить новые диагностические и терапевтические мишени при ВЗК.
ЧТО МЫ УЖЕ ЗНАЕМ?
Исследования, основанные на подробном секвенировании кишечной микобиоты в нескольких когортах пациентов , убедительно доказывают, что «грибковый дисбиоз» представляет собой одно из уникальных проявлений хронических воспалительных заболеваний кишечника (ВЗК) [2], наиболее частыми формами которых являются болезнь Крона (БК) и язвенный колит (ЯК), распространенные среди миллионов людей во всем мире. Антитела против Saccharomyces cerevisiae (ASCA), связывающие маннаны клеточной стенки грибов, различаются в зависимости от подтипа ВЗК. Например, их присутствие в сыворотке связано с БК, но не с ЯК. Это позволяет говорить о наличии связи между грибами и ВЗК. Candida — наиболее распространенный род грибов, присутствие которого последовательно возрастает в некоторых когортах пациентов с ВЗК, согласно результатам секвенирования фекальной микробиоты [2].
В частности, C. albicans в кишечнике индуцирует образование ряда противогрибковых антител и действует как иммуноген для ASCA. Виды Candida, ассоциированные со слизистой оболочкой кишечника, обнаруживаются кишечными макрофагами ,и, как было показано экспериментально, способны индуцировать защитный иммунитет или вызывать воспаление, в зависимости от контекста [3]. Несмотря на эти данные, все еще неизвестно, играют ли грибы, обнаруженные с помощью технологий секвенирования в кишечнике человека, важную роль в формировании иммунитета слизистых оболочек или развитии воспалительных заболеваний. Неоднократно наблюдалось отсутствие корреляции между изменениями в составе микобиоты и тяжестью заболевания в когортах пациентов с ВЗК, несмотря на постоянное увеличение преобладания видов Candida. Поэтому авторы выдвинули гипотезу, согласно которой функциональное разнообразие штаммов Candida определяет связи между организмом и грибковым компонентом микробиоты кишечника человека с потенциальным влиянием на воспалительные процессы в стенке кишки.
КЛЮЧЕВЫЕ МОМЕНТЫ
- Микобиота изменяется у пациентов с ВЗК, а Candida albicans оказывает провоспалительное действие
- Провоспалительные эффекты C. albicans варьируются от одного штамма к другому и способны вызывать повреждение макрофагов, а также образовывать филаменты
- Провоспалительные эффекты этих штаммов C. albicans опосредуются продукцией кандидализина и стимуляцией образования ИЛ-1β
- C. albicans, кандидализин и ИЛ-1β являются потенциальными терапевтическими мишенями при ЯК
ЧТО ГЛАВНОЕ В ЭТОМ ИССЛЕДОВАНИИ?
В соответствии с результатами ряда других исследований, авторы сначала заметили, что микобиота пациентов с ЯК содержала больше Candida albicans и меньше — Saccharomyces. При нарушениях иммунного ответа, вызванного терапией кортикостероидами, C. albicans усугубляла тяжесть колита у мышей. Затем авторы выделили несколько штаммов C. albicans из микобиоты здоровых людей и пациентов с ЯК и наблюдали широкую гетерогенность с точки зрения их провоспалительной способности. В частности, способность вызывать повреждение макрофагов, ключевого звена защиты от грибковых инфекций, варьировала от одного штамма к другому. Штаммы, способные вызывать повреждение макрофагов, имели более высокую склонность к филаментации и индукции провоспалительных эффектов по механизму Th17 in vivo (рисунок 1). Авторы показали, что большая часть провоспалительных эффектов была опосредована секрецией токсина — кандидализина — и индукцией синтеза ИЛ-1β. Последующие анализы выявили сильную корреляцию между провоспалительной способностью штаммов, выделенных у пациентов с ЯК, и воспалительной активностью заболевания. С другой стороны, корреляция между выраженностью воспаления и общим содержанием Candida albicans в кишечнике у пациентов отсутствовала. Эти результаты объясняют, почему состав микобиоты плохо коррелирует с характеристиками заболеваний, и позволяют предположить, что функциональные возможности (в данном случае провоспалительные) микобиоты могут лучше объяснить ее патогенетическую роль.
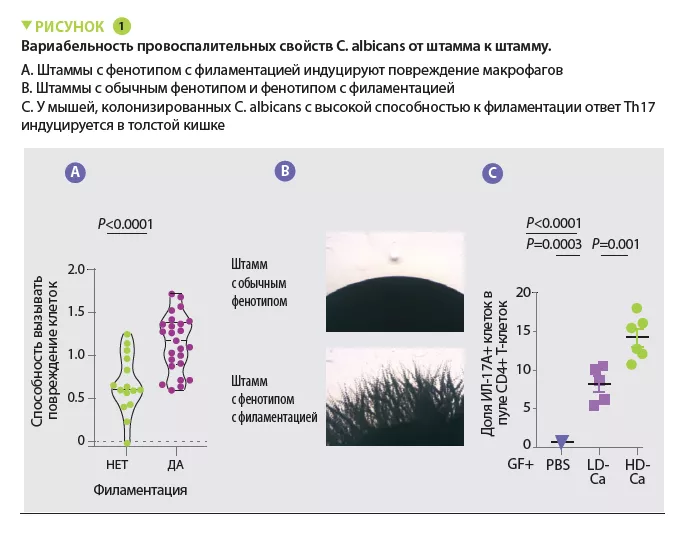
КАКОВЫ ПРАКТИЧЕСКИЕ ПОСЛЕДСТВИЯ?
Результаты исследования показывают, что в дополнение к анализу состава микобиоты, в частности путем секвенирования, необходим функциональный анализ, который позволит лучше понять вклад микобиоты в развитие заболеваний, особенно ВЗК. Если мы сможем подтвердить роль провоспалительных штаммов C. albicans, кандидализина и ИЛ-1β в развитии ЯК, у нас появится возможность создать препараты, нацеленные на один из этих элементов, особенно с учетом уже существующих молекул, блокирующих сигнальный путь ИЛ-1β.
Заключение
Результаты исследования предполагают, что кандидализин является ключевым фактором провоспалительного эффекта C. albicans в кишечнике и что некоторые высоковоспалительные штаммы действуют через ИЛ-1β-зависимые механизмы. Носители высоковоспалительных штаммов могут представлять целевую популяцию для лечения, направленного на подавление И-1 и/или C. albicans.
1. Li XV, Leonardi I, Putzel GG, et al. Immune regulation by fungal strain diversity in inflammatory bowel disease. Nature 2022 ; 603 : 672-8.
2. Sokol H, Leducq V, Aschard H, et al. Fungal microbiota dysbiosis in IBD. Gut 2017 ; 66 : 1039-48.
3. Doron I, Leonardi I, Li XV, et al. Human gut mycobiota tune immunity via CARD9-dependent induction of anti-fungal IgG antibodies. Cell 2021 ; 184 : 1017-1031.e14.








