Effet immuno-régulateur souche-dépendant des champignons dans les maladies inflammatoires chroniques de l'intestin
ARTICLE COMMENTÉ - RUBRIQUE ADULTE
Par le Pr Harry Sokol
Gastro-entérologie et nutrition, Hôpital Saint-Antoine, Paris, France
Section grand public
Retrouvez ici votre espace dédié
en_sources_title
en_sources_text_start en_sources_text_end
Chapitres

A propos de cet article
Auteur
Commentaire de l’article de Li XV et al. Nature 2022 [1]
Le microbiote fongique (mycobiote) fait partie intégrante de la communauté microbienne complexe qui colonise le tractus gastro-intestinal des mammifères et joue un rôle important dans la régulation immunitaire. Bien que des altérations du mycobiote aient été liées à plusieurs maladies, y compris les maladies inflammatoires chronique de l’intestin (MICI), on ignore actuellement si les espèces fongiques identifiées par séquençage représentent des organismes vivants et si des champignons spécifiques ont des effets sur le développement des MICI. Les auteurs ont développé une plateforme translationnelle pour l’analyse fonctionnelle du mycobiote. En combinant le séquençage à haute résolution du mycobiote, la culturomique et la génomique fongiques, un système d’édition de souches fongiques basé sur CRISPR-Cas9, des tests d’immunoréactivité fonctionnelle in vitro et des modèles in vivo, cette plateforme permet d’examiner les interactions hôte-champignon dans l’intestin humain. Ils ont découvert une riche diversité génétique de souches opportunistes de Candida albicans qui dominent la muqueuse colique des patients atteints de MICI. Parmi ces isolats, les souches ayant une forte capacité à endommager les cellules immunitaires (souches HD) reflètent les caractéristiques de la maladie des pa tients atteints de rectocolite hémorragique et aggravent l’inflammation intestinale in vivo par des mécanismes dépendants de l’IL-1β. La réponse inflammatoire et antifongique des cellules T helper produisant de l’interleukine-17A (cellules T H17) induite par les souches HD dans l’intestin dépendaient de la candidalysine, une toxine peptidique sécrétée par C. albicans, pendant la transition d’un état commensal bénin à un état pathobiont. Ces résultats révèlent la spécificité de souche des interaction s hôte-champignon dans l’intestin humain et mettent en évidence d e nouvelles cibles diagnostiques et thérapeutiques pour les MICI.
QUE SAIT-ON DÉJÀ À CE SUJET ?
Des études basées sur le séquençage profond du mycobiote intestinal dans plusieurs cohortes de maladies fournissent des preuves cohérentes que la « dysbiose fongique » est une caractéristique des maladies inflammatoires chroniques de l’intestin (MICI) [2], dont les formes les plus répandues sont la maladie de Crohn (MC) et la rectocolite hémorragique (RCH), et qui touchent des millions de personnes dans le monde. Les anticorps anti-Saccharomyces cerevisiae (ASCA), qui sont dirigés contre le mannane de la paroi des champignons, définissent les sous-types de MICI, puisque leur présence dans le sérum est associée à la MC mais pas à la RCH, ce qui établit un lien supplémentaire entre les champignons et les MICI. Candida est le genre fongique le plus répandu, et sa présence est systématiquement augmentée dans plusieurs cohortes de patients atteints de MICI analysées par séquençage du microbiote fécal [2]. Notamment, C. albicans dans l’intestin induit un ensemble d’anticorps antifongiques et agit comme un immunogène pour l’ASCA. Les espèces de Candida associées à la muqueuse intestinale sont détectées par les macrophages résidant dans l’intestin et ont donc le potentiel d’induire une immunité protectrice ou de déclencher une inflammation en fonction du contexte, de manière expérimentale [3]. Malgré ces preuves, on ignore actuellement si les champignons détectés par les technologies de séquençage dans la muqueuse intestinale humaine jouent un rôle essentiel dans l’orientation de l’immunité muqueuse ou dans l’évolution de la maladie inflammatoire de chaque patient. Il a été observé de manière répétée une absence d’association entre les changements dans la composition du mycobiote et la gravité de la maladie dans des cohortes de patients atteints de MICI, malgré une augmentation constante des espèces de Candida. Les auteurs ont donc émis l’hypothèse que la diversité fonctionnelle des souches de Candida détermine la relation hôte-champignons dans la muqueuse intestinale humaine avec un effet sur l’inflammation intestinale.
POINTS CLES
- Le mycobiote est altéré chez les patients atteints de MICI et Candida albicans a des effets pro-inflammatoires
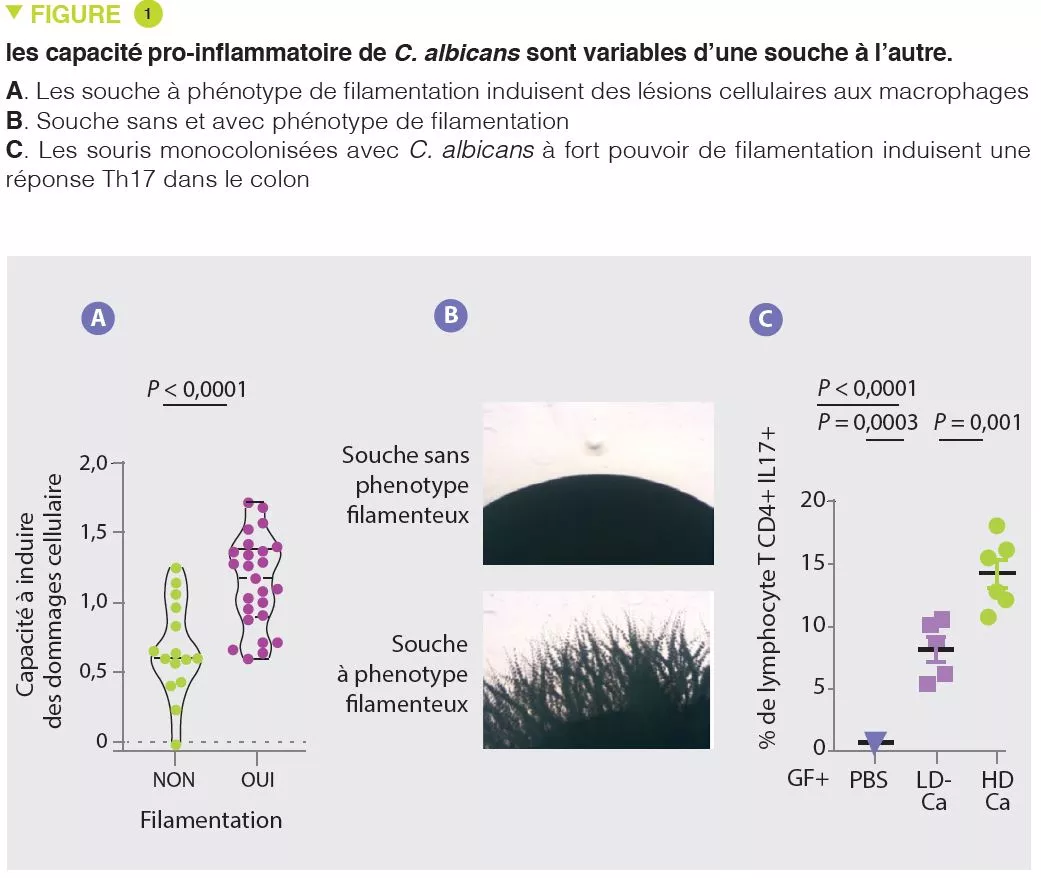
- Les effets pro-inflammatoires de C. albicans sont variables d’une souche à l’autre et sont associés à la capacité d’induire des lésions cellulaires aux macrophages et à filamenter
- Les effets pro-inflammatoires de ces souches de C. albicans sont médiés par la production de candidalysine et l’induction de la production d’IL-1β
- C. albicans, la candidalysine et l’IL-1β sont des cibles thérapeutiques potentielles dans la RCH
QUELS SONT LES PRINCIPAUX RÉSULTATS APPORTÉS PAR CETTE ÉTUDE ?
En accord avec de nombreuse études, les auteurs ont tout d’abord observé que le mycobiote des patients atteints de RCH était enrichi en Candida albicans et, au contraire, appauvri en Saccharomyces. En situation d’altération de la réponse immune induite par une corticothérapie, C. albicans aggrave la sévérité de la colite chez la souris. Les auteurs ont ensuite isolé plusieurs souches de C. albicans à partir du mycobiote de sujets sains et de patients avec RCH et ont observé une grande hétérogénéité en termes de capacité pro-inflammatoire. Notamment, la capacité d’infliger des dommages cellulaires aux macrophages, qui sont une ligne de défense clé contre les champignons est variable d’une souche à l’autre. Les souches capables d’infliger des dommages cellulaires aux macrophages ont plus tendance à filamenter et ont des effets pro-inflammatoire in vivo en induisant une reponse Th17 (Figure 1). Les auteurs ont ensuite démontré qu’une grande part de ces effets pro-inflammatoires était médiée par la sécrétion d’une toxine, la candidalysine, et l’induction de la production d’IL-1β. Les analyses suivantes ont révélé une forte corrélation entre la capacité pro-inflammatoire des souches isolées chez les patients atteints de RCH et l’activité inflammatoire de la maladie. En revanche, il n’y avait pas de corrélation entre le niveau d’inflammation intestinale et l’abondance globale de Candida albicans chez les patients. Ces résultats expliquent pourquoi la composition du mycobiote est mal corrélée aux caractéristiques des pathologies humaines et suggèrent que les capacités fonctionnelles (ici pro-inflammatoires) pourraient mieux expliquer la contribution du mycobiote à ces pathologies.
QUELLES SONT LES CONSÉQUENCES EN PRATIQUE ?
Cette étude montre que, à côté des analyses de composition du mycobiote, notamment par séquençage, une analyse au niveau fonctionnel est nécessaire pour comprendre sa contribution dans la pathologie et notamment dans les MICI. Si le rôle des souches pro-inflammatoires de C. albicans, de la candidalysine et de l’IL-1β est confirmé dans la RCH, on peut imaginer cibler l’un de ces acteurs d’un point de vue thérapeutique, d’autant que plusieurs molécules sont déjà disponibles pour antagoniser la voie de l’IL-1β.
Conclusion
Cette étude suggère que la candidalysine est un déterminant clé de l’effet proinflammatoire de C. albicans dans l’intestin, et que les souches à forte capacité proinflammatoires agissent par des mécanismes dépendant de l’IL-1β. Les patients porteurs de souches à forte capacité pro-inflammatoire pourraient représenter une population cible pour un traitement bloquant l’IL-1β et/ou C. albicans.
1. Li XV, Leonardi I, Putzel GG, et al. Immune regulation by fungal strain diversity in inflammatory bowel disease. Nature 2022 ; 603 : 672-8.
2. Sokol H, Leducq V, Aschard H, et al. Fungal microbiota dysbiosis in IBD. Gut 2017 ; 66 : 1039-48.
3. Doron I, Leonardi I, Li XV, et al. Human gut mycobiota tune immunity via CARD9-dependent induction of anti-fungal IgG antibodies. Cell 2021 ; 184 : 1017-1031.e14.






