Microbiote intestinal et troubles liés au stress
Synthèse
Par le Pr Sian M. J. Hemmings
Département de psychiatrie, Faculté de médecine et des sciences de la santé, Université de Stellenbosch, Tygerberg, Afrique du Sud
Section grand public
Retrouvez ici votre espace dédié
en_sources_title
en_sources_text_start en_sources_text_end
Chapitres

A propos de cet article
Les troubles liés au stress, notamment le trouble de stress post-traumatique (TSPT), les troubles anxieux et le trouble dépressif majeur (TDM), sont des troubles psychiatriques fréquents dont le mécanisme pathogénique clé est une réponse dysfonctionnelle au stress. Ces troubles sont très complexes et invalidants, ils sont associés à une mortalité et une morbidité accrues. De nombreuses preuves incriminent le rôle du microbiote intestinal dans les troubles psychiatriques, y compris les troubles liés au stress. La définition d’un profil microbien intestinal spécifique associé au développement des troubles psychiatriques pourrait faciliter l’identification de biomarqueurs fiables du risque associé à la maladie et permettre de prédire la prédisposition à développer de tels troubles. En outre, le microbiote intestinal peut facilement être manipulé et pourrait donc offrir une option thérapeutique simple et durable pour soulager les symptômes des troubles liés au stress. Cet article passe en revue la littérature actuelle sur l’axe microbiome-intestin-cerveau et la manière dont ce système de communication bidirectionnel pourrait jouer un rôle dans l’étiologie du TSPT, du TDM et des troubles anxieux.
TROUBLES LIÉS AU STRESS
Les troubles psychiatriques sont des troubles chroniques invalidants qui entravent considérablement le fonctionnement quotidien et figurent parmi les dix principales causes de la charge de morbidité dans le monde [1]. L’exposition à des facteurs de stress environnementaux et à des traumatismes est associée à une incidence accrue du trouble de stress post-traumatique (TSPT), du trouble dépressif majeur (TDM) et des troubles anxieux [2, 3]. Ces troubles liés au stress sont associés à une mortalité accrue, une espérance de vie réduite, une forte comorbidité et une réponse variable à la pharmacothérapie de première intention. Il n’existe pas de biomarqueurs cliniquement exploitables pour ces troubles, ce qui complique encore leur diagnostic et leur traitement. Pour faciliter le développement de nouvelles stratégies thérapeutiques et d’éventuelles interventions, il est impératif de mieux comprendre les mécanismes biologiques qui sous-tendent ces troubles.
L’AXE MICROBIOMEINTESTIN- CERVEAU (MIC)
Le terme « microbiote » désigne les milliards de micro-organismes qui vivent en nous et sur nous. Le catalogue complet de ces microbes et de leurs gènes constitue le microbiome humain. Le microbiome intestinal, crucial pour le maintien de nombreux aspects de notre fonctionnement physiologique, est un système dynamique dont la composition est affectée par de nombreux facteurs, notamment la génétique de l’hôte, son âge, son régime alimentaire et son origine ethnique [4-6]. L’axe microbiome-intestin- cerveau (MIC) est un système de communication bidirectionnel complexe entre le microbiome intestinal, l’intestin et le système nerveux central (SNC), facilité par des voies de communication directes et indirectes (Figure 1).
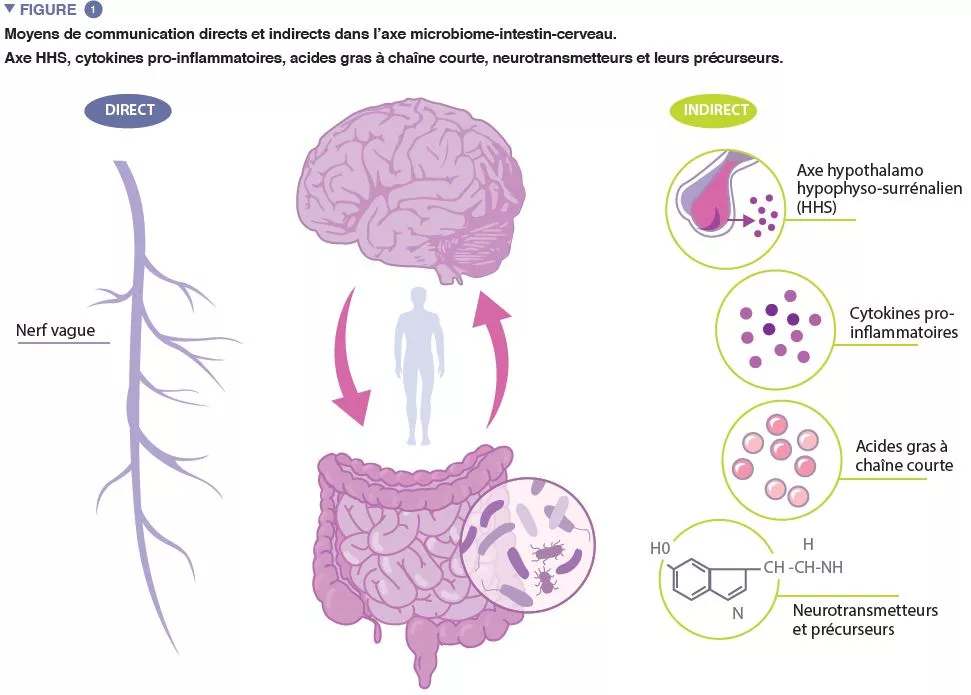
Le nerf vague, principal nerf parasympathique du système nerveux autonome, établit un lien direct entre l’intestin et le cerveau, les afférences et efférences vagales facilitant l’interaction réciproque entre le système nerveux entérique et le cerveau. La communication indirecte au sein de l’axe MIC prend de nombreuses formes. Le microbiote produit plusieurs molécules d’origine microbienne, notamment des neurotransmetteurs et des métabolites, qui agissent en plusieurs endroits de l’organisme. Il a été constaté que nombre de ces molécules, dont la sérotonine (5-HT), régulent le comportement, les fonctions cérébrales et la santé. Près de 95 % de la 5-HT de l’organisme sont produits dans les cellules entérochromaffines qui tapissent l’intestin et les taux de 5-HT dans l’intestin sont influencés par des métabolites microbiens, notamment l’indole, les acides biliaires et les acides gras à chaîne courte (AGCC). La 5-HT produite dans l’intestin ne peut pas contourner la barrière hémato- encéphalique (BHE) et ne peut donc pas affecter les taux de 5-HT dans le cerveau. Toutefois, des études chez l’animal suggèrent que les taux du précurseur de la 5-HT, le tryptophane, modulés par certaines bactéries intestinales, sont associés à la régulation de la neurotransmission de la 5-HT dans le cerveau [7].
Les études chez l’animal ont montré que les modifications des AGCC, un produit de la fermentation bactérienne des polysaccharides non digestibles par l’hôte, sont associées à l’exposition au stress chronique et à un comportement de type dépressif. Les AGCC sont impliqués dans un certain nombre de fonctions régulatrices, notamment la modulation de l’activité intestinale et de l’intégrité intestinale et l’activation de la microglie (cellules immunitaires innées du cerveau, qui jouent un rôle important dans la régulation de la survie et des réponses neuronales). Les AGCC sont capables de traverser la BHE et peuvent par conséquent affecter les fonctions cérébrales.
Il est bien établi que le microbiome intestinal joue un rôle important dans le développement des systèmes immunitaires périphérique et central et des preuves toujours plus nombreuses suggèrent qu’une inflammation accrue est associée aux troubles liés au stress. Un déséquilibre dans la composition microbienne intestinale peut compromettre l’intégrité de l’épithélium intestinal [8], augmentant la perméabilité intestinale et facilitant la translocation de bactéries, ou de composants bactériens, au travers de la barrière épithéliale vers la circulation systémique. Cela favorise une inflammation de bas grade, qui stimule l’expression accrue de cytokines pro-inflammatoires. Les cytokines pro-inflammatoires peuvent stimuler l’axe hypothalamo-hypophyso- surrénalien (HHS) pour qu’il sécrète du cortisol, ce qui peut encore augmenter la perméabilité intestinale. En effet, des preuves de dysfonctionnement des barrières intestinales et cérébrales ont été rapportées dans les troubles liés au stress.
On a constaté que l’administration systémique de lipopolysaccharides (LPS), un composant majeur de la membrane externe des bactéries à Gram négatif, entraîne une anxiété aiguë et une augmentation des symptômes de type dépressif, ainsi que des déficits cognitifs, et on a constaté que l’augmentation des taux de cytokines pro-inflammatoires induite par le LPS modifie l’activité neuronale dans les zones limbiques du cerveau. On a également constaté que le LPS induit une production accrue de cytokines dans le SNC, ce qui compromet l’intégrité de la BHE et entraîne une « fuite du cerveau ».
ÉTUDE DU MICROBIOME INTESTINAL DANS LES TROUBLES LIÉS AU STRESS : RÉSULTATS PRÉCLINIQUES ET CLINIQUES
Plusieurs études précliniques soutiennent l’idée que la composition du microbiome intestinal est associée aux troubles liés au stress. Les études utilisant des animaux sans germes (GF, microbiologiquement stériles) ont joué un rôle crucial dans notre compréhension de l’axe MIC. Dans leur étude fondamentale, Sudo et ses collègues [9] ont observé une réponse exagérée au stress, mise en évidence par des taux accrus de corticostérone, chez les souris GF par rapport aux témoins, après un stress de contrainte aigu. Cette réponse exagérée de l’axe HHS au stress a été normalisée par la mono-colonisation des souris GF avec Bifidobacterium infantum. Des études ont également montré qu’il est possible de transférer des phénotypes comportementaux de type anxieux entre deux souches de souris, au moyen d’une transplantation de microbiote fécal (TMF) [10]. De même, plusieurs études ont fait état du développement de comportements de type dépressif et anxieux, ainsi que de l’altération des voies neuroendocriniennes et immunitaires, chez des rongeurs dépourvus de microbiote à la suite d’une TMF provenant d’humains souffrant de TDM, ce qui suggère un rôle causal du microbiote intestinal dans les comportements de type dépressif [11-13]. Les études chez l’animal ont également montré que l’exposition au stress peut provoquer des altérations durables du microbiome intestinal – deux études récentes ont fait état d’une diminution de l’abondance relative d’Akkermansia muciniphila au fil du temps dans le microbiome intestinal d’animaux stressés comparativement aux animaux témoins [14, 15]. On a constaté qu’A. muciniphila et la membrane externe de la bactérie (Amuc_1100) améliorent les comportements de type dépressif et augmentent les taux circulants de 5-HT.
Comparativement, peu d’études cliniques ont été conduites pour déterminer l’association entre le microbiome intestinal et les troubles liés au stress. Jusqu’à présent, les seules données publiées sur le microbiome intestinal dans le TSPT émanent de notre groupe de recherche [16], qui a montré qu’un consortium de quatre genres bactériens permettait de prédire le statut de TSPT avec une précision de 66,4 %. On a également montré que le diagnostic de TDM dans l’échantillon était associé à une augmentation de l’abondance relative du phylum Bacteroidetes. D’autres études indiquent que les taxons bactériens associés aux troubles à la fois dépressifs et anxieux sont caractérisés par une abondance relative plus élevée de taxons induisant un environnement pro-inflammatoire et par une abondance réduite de bactéries productrices d’AGCC [17].
Ce domaine de recherche n’en est toutefois qu’à ses débuts, actuellement limité par le manque de standardisation de l’analyse du microbiome intestinal, depuis la collecte des échantillons jusqu’au pipeline analytique. Dans de nombreux cas, les facteurs susceptibles de fausser les résultats, notamment le régime alimentaire, la prise de médicaments, l’origine ethnique et la génétique de l’hôte, n’ont pas été pris en compte dans les études examinées ci-dessus. En outre, la plupart des études réalisées étaient de type transversal, limitant notre capacité à démêler les causes des conséquences, et très peu d’entre elles ont examiné les mécanismes potentiels qui sous-tendent les associations.
A. muciniphila est une bactérie anaérobie à Gram négatif, présente principalement dans la muqueuse intestinale, qui joue un rôle dans le maintien de l’intégrité de la barrière intestinale ainsi que dans la régulation immunitaire et métabolique.
MODULATION DE L’AXE MIC : LES PROBIOTIQUES
Le microbiome intestinal est traçable et peut être modulé, ce qui rend particulièrement intéressante la recherche de marqueurs du microbiome intestinal associés aux troubles liés au stress. Les probiotiques sont définis comme des micro-organismes vivants qui, lorsqu’ils sont administrés en quantités adéquates, confèrent un bénéfice pour la santé de l’hôte ; les psychobiotiques font référence aux probiotiques qui confèrent un bénéfice sur la santé mentale, la cognition et le comportement. Des publications récentes ont indiqué des effets bénéfiques modérés des psychobiotiques dans le soulagement des symptômes dépressifs et anxieux dans des cohortes à la fois saines et cliniquement définies [18]. Il est toutefois important de rester prudent lors de l’interprétation des résultats des études actuelles, car celles-ci sont variables en ce qui concerne la formulation et la posologie des probiotiques, les caractéristiques de l’échantillon (phénotype clinique et sévérité de la dépression/anxiété) et la durée du suivi. De plus, les avantages des psychobiotiques par rapport aux antidépresseurs et leurs interactions avec ces derniers n’ont pas encore été étudiés de manière approfondie, même si certains résultats intéressants d’études précliniques suggèrent que certains probiotiques, lorsqu’ils sont administrés sous forme de préparations à souches multiples, ont des effets antidépresseurs similaires, voire parfois plus importants, que les antidépresseurs actuels administrés en première intention [19]. Ces psychobiotiques, s’ils sont utilisés conjointement avec des antidépresseurs, pourraient avoir une utilité particulière chez les personnes souffrant de dépression résistante au traitement.
Conclusion
Les preuves suggérant que le microbiome intestinal est modifié dans les troubles liés au stress ne cessent de s’accumuler et même si beaucoup de travail reste à faire dans ce domaine, la détermination d’un profil microbien intestinal spécifique associé au développement des troubles liés au stress pourrait faciliter l’identification de biomarqueurs fiables du risque associé à la maladie et permettre de prédire la prédisposition à développer ces troubles. Le microbiome intestinal peut facilement être manipulé et pourrait donc offrir une option thérapeutique simple et durable pour soulager les symptômes du TSPT, du TDM et des troubles anxieux.
• 1. GBD 2019 Mental Disorders Collaborators. Global, regional, and national burden of 12 mental disorders in 204 countries and territories, 1990–2019: a systematic analysis for the Global Burden of Disease Study 2019. Lancet Psychiatry 2022; 9: 137-50.
• 2. van Praag HM. Can stress cause depression? Prog Neuropsychopharmacol Biol Psychiatry 2004; 28: 891-907.
• 3. Shin LM, Liberzon I. The neurocircuitry of fear, stress, and anxiety disorders. Neuropsychopharmacol 2010; 35: 169-91.
• 4. De Filippo C, Cavalieri D, Di Paola M, Ramazzotti M, Poullet JB, Massart S, et al. Impact of diet in shaping gut microbiota revealed by a comparative study in children from Europe and rural Africa. Proc Natl Acad Sci USA 2010; 107: 14691-6.
• 5. Schnorr SL, Candela M, Rampelli S, Centanni M, Consolandi C, Basaglia G. Gut microbiome of the Hadza hunter-gatherers. Nat Commun 2014; 5: 3564.
• 6. Ayeni FA, Biagi E, Rampelli S, et al. Infant and Adult Gut Microbiome and Metabolome in Rural Bassa and Urban Settlers from Nigeria. Cell Rep 2018; 23: 3056-67.
• 7. Clarke G, Grenham S, Scully P, et al. The microbiome-gut-brain axis during early life regulates the hippocampal serotonergic system in a sex-dependent manner. Molecular Psychiatry 2013; 18: 666-73.
• 8. Desbonnet L, Garrett L, Clarke G, Kiely B, Cryan JF, Dinan TG. Effects of the probiotic Bifidobacterium infantis in the maternal separation model of depression. Neuroscience 2010; 170: 1179-88.
• 9. Sudo N, Chida Y, Aiba Y, Sonoda J, Oyama N, Yu XN. Postnatal microbial colonization programs the hypothalamic-pituitary-adrenal system for stress response in mice. J Physiol 2004; 558: 263-75.
• 10. Bercik P, Denou E, Collins J, et al. The intestinal microbiota affect central levels of brain-derived neurotropic factor and behavior in mice. Gastroenterology 2011; 141: 599-609.
• 11. Kelly JR, Borre Y, O’ Brien C, Patterson E, El Aidy S, Deane J, et al. Transferring the blues: Depression-associated gut microbiota induces neurobehavioural changes in the rat. J Psychiatr Res 2016; 82: 109-18.
• 12. Liu S, Guo R, Liu F, Yuan Q, Yu Y, Ren F. Gut microbiota regulates depression-like behavior in rats through the neuroendocrine-immune-mitochondrial pathway. Neuropsychiatr Dis Treat 2020; 16: 859-69.
• 13. Zheng P, Zeng B, Zhou C, et al. Gut microbiome remodeling induces depressive-like behaviors through a pathway mediated by the host’s metabolism. Mol Psychiatry 2016; 21: 786-96.
• 14. Hoke A, Chakraborty N, Gautam A, Hammamieh R, Jett M. Acute and delayed effects of stress eliciting post-traumatic stress-like disorder differentially alters fecal microbiota composition in a male mouse model. Front Cell Infect Microbiol 2022; 12: 810815.
• 15. Pascual Cuadrado D, Todorov H, Lerner R, et al. Long-term molecular differences between resilient and susceptible mice after a single traumatic exposure. Br J Pharmacol 2022; 179: 4161-80.
• 16. Malan-Muller S, Valles-Colomer M, Foxx CL, et al. Exploring the relationship between the gut microbiome and mental health outcomes in a posttraumatic stress disorder cohort relative to trauma-exposed controls. Eur Neuropsychopharmacol 2022; 56: 24-38.
• 17. Simpson CA, Diaz-Arteche C, Eliby D, Schwartz OS, Simmons JG, Cowan CSM. The gut microbiota in anxiety and depression - A systematic review. Clin Psychol Rev 2021;83: 101943.
• 18. Alli SR, Gorbovskaya I, Liu JCW, Kolla NJ, Brown L, Müller DJ. The gut microbiome in depression and potential benefit of prebiotics, probiotics and synbiotics: a systematic review of clinical trials and observational studies. Int J Mol Sciences 2022; 23: 4494.
• 19. Ra Y, Eu P, Ev V, Mv O, Mv M, Gi K, et al. A Multi-strain potential probiotic formulation of GABA-producing Lactobacillus plantarum 90sk and Bifidobacterium adolescentis 150 with antidepressant effects. Probiotics and Antimicrobial Proteins 2020; 12: 973-9.





