La microbiota intestinal y los trastornos relacionados con el estrés
Síntesis
Por la Prof. Sian M. J. Hemmings
Departamento de Psiquiatría, Facultad de Medicina y Ciencias de la Salud, Universidad de Stellenbosch, Tygerberg, Sudáfrica
Espacio para el público general
Encuentra aquí tu espacio dedicado
en_sources_title
en_sources_text_start en_sources_text_end
Capítulos

Acerca de este artículo
Los trastornos relacionados con el estrés, como el trastorno de estrés postraumático (TEPT), los trastornos de ansiedad y el trastorno depresivo mayor (TDM), son trastornos psiquiátricos comunes, cuya respuesta disfuncional al estrés constituye un mecanismo patogénico clave. Estos trastornos son muy complejos y debilitantes, y se asocian a una mayor mortalidad y morbilidad. Existen numerosas pruebas que implican la función de la microbiota intestinal en los trastornos psiquiátricos, incluidos los trastornos relacionados con el estrés. Definir un perfil microbiano intestinal específico asociado a la aparición de trastornos psiquiátricos puede facilitar la identificación de biomarcadores de riesgo fiables asociados a la enfermedad y predecir la predisposición para padecer dichos trastornos. Además, la microbiota intestinal puede manipularse con facilidad y, por tanto, puede ofrecer una opción de tratamiento sencilla y sostenible para aliviar los síntomas de los trastornos relacionados con el estrés. En este artículo se revisan los datos publicados actuales sobre el eje microbioma-intestino-cerebro y cómo este sistema bidireccional de comunicación puede desempeñar una función en la etiología del TEPT, TDM y de los trastornos de ansiedad.
TRASTORNOS RELACIONADOS CON EL ESTRÉS
Los trastornos psiquiátricos son trastornos crónicos y debilitantes que perjudican considerablemente el funcionamiento diario, y se encuentran entre las diez principales causas de enfermedad en todo el mundo [1]. La exposición a factores ambientales estresantes y traumáticos se asocia con una mayor incidencia del trastorno de estrés postraumático (TEPT), el trastorno depresivo mayor (TDM) y los trastornos de ansiedad [2, 3]. Estos trastornos relacionados con el estrés se asocian a un aumento de la mortalidad y a una menor esperanza de vida, tienen una alta morbilidad asociada y presentan una respuesta variable a la farmacoterapia de primera línea. No existen biomarcadores clínicamente aplicables para estos trastornos, lo que complica aún más su diagnóstico y tratamiento. Para facilitar el desarrollo de nuevas estrategias terapéuticas y posibles intervenciones, es necesario que profundicemos en los mecanismos biológicos subyacentes a estos trastornos.
EL EJE MICROBIOMAINTESTINO- CEREBRO (MIC)
“Microbiota” es el término que se refiere a los billones de microorganismos que viven con nosotros y en nosotros. El catálogo completo de estos microbios y sus genes conforma el microbioma humano. El microbioma intestinal, fundamental para mantener numerosos aspectos de nuestro funcionamiento fisiológico, es un sistema dinámico, en cuya composición influyen cantidad de factores, como la genética del anfitrión, la edad, la alimentación y el grupo étnico [4-6]. El eje microbioma-intestino- cerebro (MIC) es un complejo sistema bidireccional de comunicación entre el microbioma intestinal, el intestino y el sistema nervioso central (SNC), facilitado por vías de comunicación directas e indirectas (Figura 1).
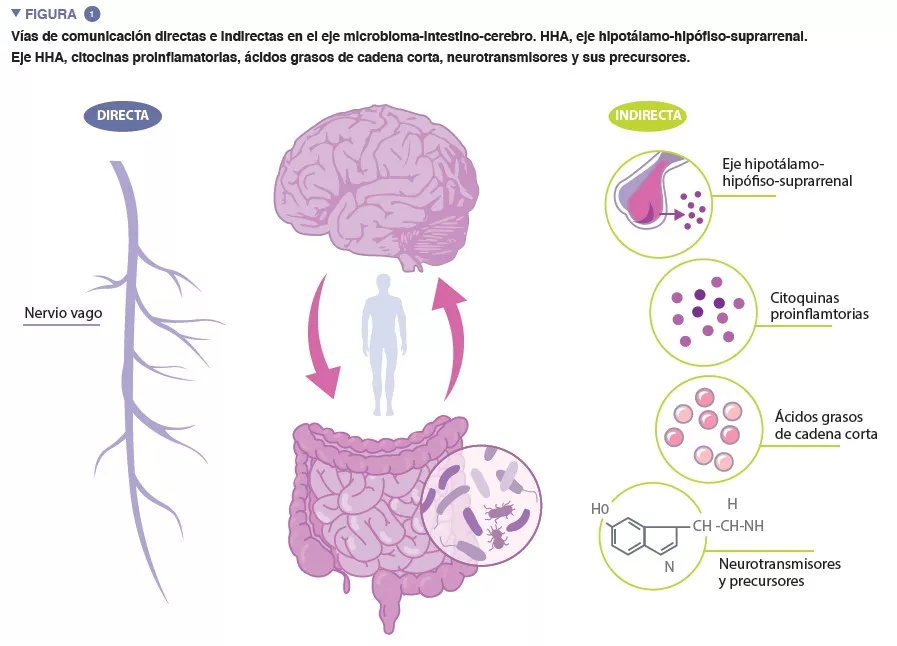
El nervio vago, el principal nervio parasimpático del sistema neurovegetativo, es una conexión directa entre el intestino y el cerebro, con aferentes y eferentes del nervio vago que facilitan la interacción recíproca entre el sistema nervioso intestinal y el cerebro. La comunicación indirecta dentro del eje MIC adopta numerosas formas. La microbiota produce varias moléculas derivadas del microbioma, como neurotransmisores y metabolitos, que intervienen en numerosas partes del cuerpo. Se ha observado que muchas de estas moléculas, incluida la serotonina (5-HT), regulan el comportamiento, la función cerebral y la salud. Hasta el 95 % de la 5-HT del cuerpo se produce en las células enterocromafines que recubren el intestino, y los metabolitos microbianos, como el indol, y los niveles de 5-HT del intestino influyen en los metabolitos microbianos como el indol, los ácidos biliares y los ácidos grasos de cadena corta (AGCC). La 5-HT producida en el intestino no puede eludir la barrera hematoencefálica (BHE) y, por tanto, no puede afectar a los niveles de 5-HT en el cerebro. Sin embargo, estudios en animales han aportado pruebas que sugieren que los niveles del precursor de la 5-HT, el triptófano, modulados por ciertas bacterias intestinales, se asocian a la regulación de la neurotransmisión de la 5-HT en el cerebro [7].
Se ha observado que alteraciones en los AGCC, producto de la fermentación bacteriana de polisacáridos no digeribles por el anfitrión, están asociadas a la exposición al estrés crónico y a un comportamiento depresivo en estudios con animales. Los AGCC intervienen en una serie de funciones reguladoras, como la modulación de la actividad y la integridad intestinal y la activación de la microglía (células inmunitarias innatas del cerebro, que desempeñan un importante papel en la regulación de la supervivencia y las respuestas neuronales). Los AGCC son capaces de atravesar la BHE y, al hacerlo, pueden influir en la función cerebral.
Está bien demostrado que el microbioma intestinal desempeña un papel importante en el desarrollo tanto del sistema inmunitario periférico como del central, y cada vez hay más pruebas que sugieren que el aumento de la inflamación está asociado a los trastornos relacionados con el estrés. Un desequilibrio en la composición microbiana intestinal puede alterar la integridad del epitelio intestinal [8], aumentando la permeabilidad intestinal y facilitando la translocación bacteriana o de componentes bacterianos, de la barrera epitelial a la circulación sistémica. Esto favorece la inflamación de baja intensidad, que estimula el aumento de la expresión de citocinas proinflamatorias. Las citocinas proinflamatorias pueden estimular el eje hipotálamo- hipófiso-suprarrenal (HHA) para que segregue cortisol, lo que puede aumentar todavía más la permeabilidad intestinal. De hecho, se ha descrito la existencia de una disfunción de la barrera intestinal y cerebral en los trastornos relacionados con el estrés.
Se ha descubierto que la administración generalizada de lipopolisacáridos (LPS), un componente principal de la membrana externa de las bacterias gramnegativas, provoca ansiedad aguda y un aumento de los síntomas depresivos, así como déficits cognitivos, y se ha observado que un aumento de los niveles de citocinas proinflamatorias inducido por los LPS altera la actividad neuronal en las zonas límbicas del cerebro. Además, se ha descubierto que los LPS inducen un aumento de la producción de citocinas en el SNC, lo que pone en peligro la integridad de la BHE, y da lugar a un “cerebro permeable”.
INVESTIGACIÓN DEL MICROBIOMA INTESTINAL EN LOS TRASTORNOS RELACIONADOS CON EL ESTRÉS: HALLAZGOS PRECLÍNICOS Y CLÍNICOS
Varias investigaciones preclínicas respaldan la idea de que la composición del microbioma intestinal está asociada a trastornos relacionados con el estrés. Las investigaciones con animales axénicos (estériles microbiológicamente), ha desempeñado un papel fundamental en nuestro entendimiento del eje MIC. En su investigación original, Sudo et al. [9] observaron una respuesta de estrés exagerada, puesta de manifiesto por el aumento de los niveles de corticosterona en ratones axénicos, en comparación con los ratones control, tras ser sometidos a un estrés agudo por restricción de movimiento. Esta exagerada respuesta del eje HHA al estrés se normalizó tras la monocolonización de los ratones axénicos con Bifidobacterium infantum. Los estudios también han mostrado que es posible transferir fenotipos de comportamiento ansioso entre dos razas de ratón, mediante el trasplante de microbiota fecal (TMF) [10]. De la misma manera, numerosos estudios han informado sobre la aparición de comportamientos depresivos y ansiosos, y de la alteración de las vías neuroendocrinas e inmunitarias en roedores con una microbiota reducida tras un TMF de humanos diagnosticados con TDM, lo que sugiere una función causal de la microbiota intestinal en el comportamiento depresivo [11-13]. Estudios en animales han demostrado también que la exposición al estrés puede causar alteraciones duraderas en el microbioma intestinal: dos estudios recientes han señalado una reducción de la abundancia relativa de Akkermansia muciniphila en el microbioma intestinal de animales estresados a lo largo del tiempo, en comparación con animales control [14, 15]. Se ha descubierto que A. muciniphila y la membrana exterior de las bacterias (Amuc_1100) mejoran el comportamiento depresivo, y aumentan los niveles circulatorios de 5-HT.
Se han realizado comparativamente pocos estudios clínicos para determinar la asociación entre el microbioma intestinal y los trastornos relacionados con el estrés. Hasta el momento, los únicos datos publicados sobre el microbioma intestinal en el TEPT provienen de nuestro grupo de investigación [16], que descubrió un consorcio de cuatro géneros bacterianos que predecía el estado de TEPT con una precisión del 66,4 %. Además, se comprobó que el diagnóstico del TDM estaba asociado a un aumento de la abundancia relativa del filo Bacteroidetes. Otros estudios indican que los taxones bacterianos asociados tanto a la depresión como a los trastornos de ansiedad se caracterizan por una mayor abundancia relativa de taxones que producen un entorno proinflamatorio y una menor abundancia de bacterias productoras de AGCC [17].
Sin embargo, este campo de investigación está todavía en ciernes, y se encuentra limitado actualmente por la falta de estandarización en el análisis del microbioma intestinal, desde la recogida de muestras hasta el proceso de análisis. En muchos casos, factores que pueden influir en los resultados, como la alimentación, el uso de medicamentos, el grupo étnico y la genética del anfitrión no se tuvieron en cuenta en los estudios revisados anteriormente. Además, la mayoría de los estudios realizados han tenido un diseño transversal, lo que limita nuestra capacidad para separar las causas de las consecuencias, y muy pocos han investigado los posibles mecanismos subyacentes a las asociaciones.
A. muciniphila en una bacteria anaerobia gramnegativa que se encuentra principalmente en la mucosa intestinal y que desempeña un papel en el mantenimiento de la integridad de la barrera intestinal, además de en la regulación inmunitaria y metabólica.
MODULACIÓN DEL EJE MIC: LOS PROBIÓTICOS
El microbioma intestinal es manejable y se puede modular, lo que hace especialmente atractiva la búsqueda de marcadores del microbioma intestinal asociados a trastornos relacionados con el estrés. Los probióticos se definen como microrganismos vivos que, cuando se administran en cantidades adecuadas, aportan un beneficio para la salud del anfitrión; los psicobióticos se refieren a probióticos que aportan un beneficio en la salud mental, la cognición y el comportamiento. Algunas publicaciones recientes han señalado efectos beneficiosos moderados de los psicobióticos en el alivio de síntomas depresivos y ansiosos tanto en cohortes sanas como en cohortes definidas clínicamente [18]. Sin embargo, es importante ser prudente a la hora de interpretar los resultados de los estudios actuales, ya que son variables en cuanto a la formulación y la dosificación de los probióticos, las características de la muestra (fenotipo clínico y gravedad de la depresión/ ansiedad) y el tiempo de seguimiento. Además, aún no se ha investigado en profundidad el beneficio de los psicobióticos sobre la medicación antidepresiva ni las interacciones con ella, aunque algunos resultados interesantes de estudios preclínicos sugieren que ciertos probióticos, cuando se administran en un formato con varias cepas, tienen efectos antidepresivos similares, y a veces con mayor efecto, que los antidepresivos actuales de primera línea [19]. Estos psicobióticos, si se utilizan combinados con antidepresivos, pueden ser especialmente útiles en personas con depresión resistente al tratamiento.
Conclusión
Siguen apareciendo hallazgos que sugieren que el microbioma intestinal se encuentra alterado en trastornos relacionados con el estrés, y aunque aún falta mucho trabajo por hacer en este campo, definir un perfil microbiano intestinal específico asociado a la aparición de trastornos psiquiátricos podría facilitar la identificación de biomarcadores fiables asociados al riesgo de enfermedad y predecir la predisposición para padecer dichos trastornos. El microbioma intestinal puede manipularse fácilmente, por lo que podría ofrecer una opción de tratamiento sencilla y sostenible para aliviar los síntomas del TEPT, el TDM y los trastornos de ansiedad.
• 1. GBD 2019 Mental Disorders Collaborators. Global, regional, and national burden of 12 mental disorders in 204 countries and territories, 1990–2019: a systematic analysis for the Global Burden of Disease Study 2019. Lancet Psychiatry 2022; 9: 137-50.
• 2. van Praag HM. Can stress cause depression? Prog Neuropsychopharmacol Biol Psychiatry 2004; 28: 891-907.
• 3. Shin LM, Liberzon I. The neurocircuitry of fear, stress, and anxiety disorders. Neuropsychopharmacol 2010; 35: 169-91.
• 4. De Filippo C, Cavalieri D, Di Paola M, Ramazzotti M, Poullet JB, Massart S, et al. Impact of diet in shaping gut microbiota revealed by a comparative study in children from Europe and rural Africa. Proc Natl Acad Sci USA 2010; 107: 14691-6.
• 5. Schnorr SL, Candela M, Rampelli S, Centanni M, Consolandi C, Basaglia G. Gut microbiome of the Hadza hunter-gatherers. Nat Commun 2014; 5: 3564.
• 6. Ayeni FA, Biagi E, Rampelli S, et al. Infant and Adult Gut Microbiome and Metabolome in Rural Bassa and Urban Settlers from Nigeria. Cell Rep 2018; 23: 3056-67.
• 7. Clarke G, Grenham S, Scully P, et al. The microbiome-gut-brain axis during early life regulates the hippocampal serotonergic system in a sex-dependent manner. Molecular Psychiatry 2013; 18: 666-73.
• 8. Desbonnet L, Garrett L, Clarke G, Kiely B, Cryan JF, Dinan TG. Effects of the probiotic Bifidobacterium infantis in the maternal separation model of depression. Neuroscience 2010; 170: 1179-88.
• 9. Sudo N, Chida Y, Aiba Y, Sonoda J, Oyama N, Yu XN. Postnatal microbial colonization programs the hypothalamic-pituitary-adrenal system for stress response in mice. J Physiol 2004; 558: 263-75.
• 10. Bercik P, Denou E, Collins J, et al. The intestinal microbiota affect central levels of brain-derived neurotropic factor and behavior in mice. Gastroenterology 2011; 141: 599-609.
• 11. Kelly JR, Borre Y, O’ Brien C, Patterson E, El Aidy S, Deane J, et al. Transferring the blues: Depression-associated gut microbiota induces neurobehavioural changes in the rat. J Psychiatr Res 2016; 82: 109-18.
• 12. Liu S, Guo R, Liu F, Yuan Q, Yu Y, Ren F. Gut microbiota regulates depression-like behavior in rats through the neuroendocrine-immune-mitochondrial pathway. Neuropsychiatr Dis Treat 2020; 16: 859-69.
• 13. Zheng P, Zeng B, Zhou C, et al. Gut microbiome remodeling induces depressive-like behaviors through a pathway mediated by the host’s metabolism. Mol Psychiatry 2016; 21: 786-96.
• 14. Hoke A, Chakraborty N, Gautam A, Hammamieh R, Jett M. Acute and delayed effects of stress eliciting post-traumatic stress-like disorder differentially alters fecal microbiota composition in a male mouse model. Front Cell Infect Microbiol 2022; 12: 810815.
• 15. Pascual Cuadrado D, Todorov H, Lerner R, et al. Long-term molecular differences between resilient and susceptible mice after a single traumatic exposure. Br J Pharmacol 2022; 179: 4161-80.
• 16. Malan-Muller S, Valles-Colomer M, Foxx CL, et al. Exploring the relationship between the gut microbiome and mental health outcomes in a posttraumatic stress disorder cohort relative to trauma-exposed controls. Eur Neuropsychopharmacol 2022; 56: 24-38.
• 17. Simpson CA, Diaz-Arteche C, Eliby D, Schwartz OS, Simmons JG, Cowan CSM. The gut microbiota in anxiety and depression - A systematic review. Clin Psychol Rev 2021;83: 101943.
• 18. Alli SR, Gorbovskaya I, Liu JCW, Kolla NJ, Brown L, Müller DJ. The gut microbiome in depression and potential benefit of prebiotics, probiotics and synbiotics: a systematic review of clinical trials and observational studies. Int J Mol Sciences 2022; 23: 4494.
• 19. Ra Y, Eu P, Ev V, Mv O, Mv M, Gi K, et al. A Multi-strain potential probiotic formulation of GABA-producing Lactobacillus plantarum 90sk and Bifidobacterium adolescentis 150 with antidepressant effects. Probiotics and Antimicrobial Proteins 2020; 12: 973-9.





