Микробиота кишечника и стрессовые расстройства
Обзорная статья
Проф. Шан М. Дж. Хеммингс (Sian M. J. Hemmings)
Кафедра психиатрии медицинского факультета Университета Стелленбош, Тайгерберг, Южная Африка
Раздел для широкой публики
Найдите здесь свое выделенное место
en_sources_title
en_sources_text_start en_sources_text_end
Делиться - значит заботиться
Возможно, эта тема заинтересует ваших коллег. Почему бы не поделиться ею?
Разделы

Об этой статье
Стрессовые расстройства, включая посттравматическое стрессовое расстройство (ПТСР), большое депрессивное расстройство (БДР) и тревожные расстройства — часто встречающиеся психические нарушения, в основе которых лежит патологическая реакция на стресс. Эти расстройства очень многогранны, но все они, как правило, тяжело переносятся, вызывают различные осложнения и даже могут приводить к смерти. Собрано немало данных о роли микробиоты кишечника в развитии психических расстройств, в том числе связанных со стрессом. Определение специфического микробного профиля кишечника может выявить надежные биомаркеры рисков, связанных с заболеванием, и позволит на их основе прогнозировать вероятность развития нарушений. Кроме того, микробиота кишечника легко поддается воздействию и может помочь в облегчении симптомов стрессовых расстройств. В статье рассматриваются последние данные о возможном участии двунаправленной оси «микробиом — кишечник — головной мозг» в развитии стрессовых расстройств, таких как ПТСР, тревожные расстройства и БДР.
СТРЕССОВЫЕ РАССТРОЙСТВА
Психические расстройства — это хронические изнурительные состояния, которые значительно ухудшают повседневную деятельность и входят в десятку наиболее распространенных заболеваний в мире [1]. Совокупность стрессовых факторов окружающей среды и психологической травмы могут стать причиной возникновения посттравматического стрессового расстройства (ПТСР), большого депрессивного расстройства (БДР) и тревожных расстройств [2, 3]. Эти состояния приводят к увеличению смертности и снижению ожидаемой продолжительности жизни, сопровождаются осложнениями и вариабельно отвечают на медикаментозное лечение первой линии. Отсутствие клинически значимых биомаркеров для этих расстройств еще больше осложняет их диагностику и лечение. Чтобы облегчить разработку новых терапевтических стратегий и возможных методов лечения, следует глубже понять биологические механизмы, лежащие в основе этих расстройств.
ОСЬ МИКРОБИОМ — КИШЕЧНИК — ГОЛОВНОЙ МОЗГ (МКГ)
«Микробиота» — термин, относящийся к триллионам микроорганизмов, живущих внутри и на поверхности нашего тела. Совокупность этих микроорганизмов и их генов составляет микробиом человека. Микробиом кишечника, играющий важную роль в поддержании различных физиологических функций организма, представляет собой динамическую систему, на состав которой влияют многочисленные факторы, включая генотип, возраст, питание и этническую принадлежность [4-6]. Ось «микробиом — кишечник — головной мозг» (МКГ) представляет собой сложную двунаправленную систему связи между микробиомом кишечника, собственно кишечником и центральной нервной системой (ЦНС) (рис. 1).
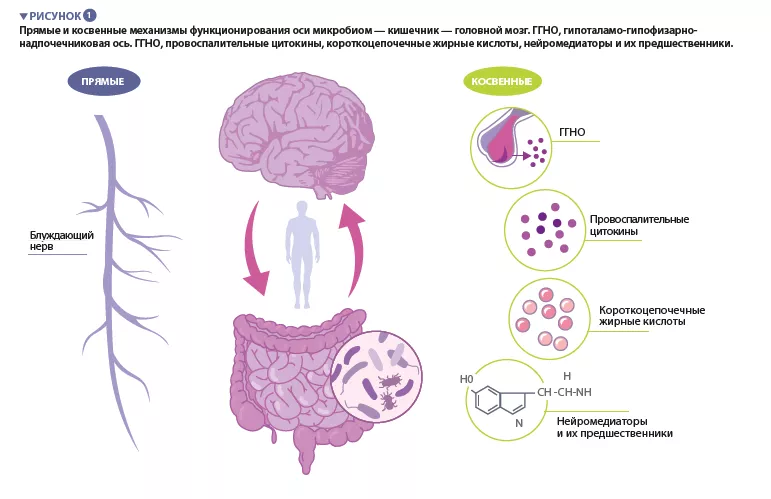
Блуждающий нерв — основной парасимпатический нерв вегетативной нервной системы — обуславливает прямое и двунаправленное взаимодействие между кишечником, головным мозгом и энтеральной нервной системой. Косвенные связи в пределах оси МКГ принимают различные формы. Микробиота продуцирует ряд молекул, включая нейромедиаторы и метаболиты, которые действуют в разных Блуждающий нерв — основной парасимпатический нерв вегетативной нервной системы — обуславливает прямое и двунаправленное взаимодействие между кишечником, головным мозгом и энтеральной нервной системой. Косвенные связи в пределах оси МКГ принимают различные формы. Микробиота продуцирует ряд молекул, включая нейромедиаторы и метаболиты, которые действуют в разных
У животных уровни КЦЖК, образуемых в результате бактериальной ферментации неперевариваемых полисахаридов, изменялись под воздействием хронического стресса и при депрессивных состояниях. КЦЖК участвуют в ряде регуляторных функций, включая модуляцию активности и целостности кишечника, а также активацию микроглии (клеток врожденного иммунитета в головном мозге, играющих важную роль в регуляции выживаемости и функционирования нейронов). КЦЖК способны проникать через ГЭБ и влиять на функции мозга.
Известно, что микробиом кишечника играет важную роль в развитии компонентов периферической и центральной иммунной системы, а новые данные показывают связь между повышенным воспалением и стрессовыми расстройствами. Дисбаланс микробного состава кишечника может нарушить целостность кишечного эпителия [8], повышая его проницаемость и облегчая транслокацию бактерий или бактериальных компонентов через эпителиальный барьер в системный кровоток. Это способствует образованию слабого воспалительного фона, что стимулирует повышенную экспрессию провоспалительных цитокинов. Провоспалительные цитокины могут стимулировать гипоталамо-гипофизарно- надпочечниковую ось (ГГНО), что приводит к выделению кортизола, который может дополнительно повысить проницаемость кишечника. Действительно, при стрессовых расстройствах были зарегистрированы признаки дисфункции кишечного и гематоэнцефалического барьеров.
Показано, что системное введение липополисахаридов (ЛПС), основного компонента наружной мембраны грамотрицательных бактерий, вызывает острое тревожное состояние, а также усиление депрессивных симптомов и когнитивных нарушений. Помимо этого, индуцированное ЛПС повышение уровней провоспалительных цитокинов изменяет активность нейронов в лимбической области головного мозга. ЛПС также индуцируют повышенное образование цитокинов в ЦНС, нарушая целостность и увеличивая проницаемость ГЭБ.
ИССЛЕДОВАНИЕ КИШЕЧНОГО МИКРОБИОМА ПРИ СТРЕССОВЫХ РАССТРОЙСТВАХ: РЕЗУЛЬТАТЫ ДОКЛИНИЧЕСКИХ И КЛИНИЧЕСКИХ ИССЛЕДОВАНИЙ
Результаты нескольких доклинических исследований подтверждают идею о связи между составом кишечного микробиома и стрессовыми расстройствами. Исследования на микробиологически стерильных (т. е. не содержащих в организме микробов) животных сыграли решающую роль в нашем понимании оси МКГ. Sudo и соавт. [9] одними из первых наблюдали избыточную реакцию на острый стресс в виде повышения уровня кортикостерона у стерильных мышей по сравнению с контрольными животными. Этот избыточный ответ со стороны ГГНО удавалось нормализовать после колонизации кишечника стерильных мышей с помощью Bifidobacterium infantum. Исследования также показали возможность переноса тревожного фенотипа между двумя штаммами мышей с помощью трансплантации фекальной микробиоты (ТФМ) [10]. Еще в нескольких исследованиях сообщалось о развитии депрессивного и тревожного поведения и изменении функционирования нейроэндокринно-иммунных сигнальных путей у грызунов с обедненной микробиотой, которым проводили ТФМ от людей с диагнозом БДР. Это указывает на причинно-следственную связь между микробиотой кишечника и развитием депрессивного поведения [11-13]. Исследования на животных также показали, что стресс может вызвать длительные изменения в микробиоме кишечника. Так, в двух недавних исследованиях сообщалось о постепенном снижении относительного содержания Akkermansia muciniphila в микробиоме кишечника подвергаемых стрессу животных по сравнению с контрольными животными [14, 15]. Обнаружено, что A. muciniphila и компоненты их внешней мембраны (Amuc_1100) уменьшают депрессивное поведение и повышают уровни 5-ГТ в кровотоке.
На данный момент проведено относительно мало клинических исследований по оценке связи между микробиомом кишечника и стрессовыми расстройствами. Единственные опубликованные данные о характеристиках микробиома кишечника при ПТСР принадлежат нашей исследовательской команде [16]. Показано, что группа из четырех родов бактерий позволяет предсказать развитие ПТСР с точностью до 66,4%. Кроме того, диагноз БДР ассоциировался с повышенной относительной распространенностью филума Bacteroidetes в кале. Другие исследования показывают, что бактериальные сообщества, ассоциированные с депрессией и тревожными расстройствами, характеризуются более высокой относительной распространенностью таксонов, индуцирующих провоспалительный фон, и меньшей распространенностью бактерий, продуцирующих КЦЖК [17].
Эта область исследований еще находится в зачаточном состоянии и ограничена отсутствием стандартизации в подходах к анализу микробиома кишечника, начиная от взятия образцов и заканчивая оцениваемыми характеристиками. Во многих случаях в рассмотренных выше исследованиях не учитывались факторы, способные затруднить интерпретацию результатов, включая питание, применение лекарственных препаратов, этническую принадлежность и генотип. Кроме того, большинство исследований были перекрестными, что ограничивало возможность отделить причины от следствий, и лишь в единичных изучались потенциальные механизмы, лежащие в основе рассматриваемых ассоциаций.
A. muciniphila — грамотрицательная анаэробная бактерия, обнаруживаемая главным образом в слизистой оболочке кишечника. Она играет роль в поддержании целостности кишечного барьера, а также в процессах иммунной и метаболической регуляции.
МОДУЛЯЦИЯ ОСИ МКГ: ПРОБИОТИКИ
Микробиом кишечника отвечает на различные воздействия, т. е. поддается модуляции, что открывает возможности поиска маркеров микробиома кишечника, связанных со стрессовыми расстройствами. Пробиотики — живые микроорганизмы, которые при введении в достаточных количествах приносят пользу здоровью человека. В свою очередь, психобиотики — это пробиотики, которые благоприятно влияют на психическое здоровье, восприятие и поведение. В недавних работах отмечается умеренное положительное влияние психобиотиков на депрессивные и тревожные симптомы как у пациентов, так и у здоровых людей [18]. Однако результаты этих исследований нужно интерпретировать с осторожностью, поскольку они различаются в плане состава и дозировки пробиотиков, анализируемых характеристик (клинический фенотип и степень тяжести депрессии / тревоги) и времени наблюдения за участниками. Кроме того, преимущества психобиотиков по сравнению с антидепрессантами и взаимодействие с ними еще не были широко изучены, хотя часть доклинических данных позволяет предположить, что некоторые пробиотики оказывают антидепрессивное действие, не уступающее, а иногда и превосходящее эффекты антидепрессантов первой линии [19]. Такие психобиотики в сочетании с антидепрессантами могут быть особенно полезны пациентам с депрессией, резистентной к лечению.
Заключение
Все больше исследований доказывают, что микробиом кишечника изменяется при стрессовых расстройствах. Хотя в этой области еще предстоит большая работа, определение специфического микробного профиля кишечника, связанного с развитием стрессовых расстройств, может помочь выявить надежные биомаркеры рисков, связанных с заболеванием, которые позволят прогнозировать вероятность развития этих расстройств. Микробиом кишечника легко поддается манипуляциям и может помочь в облегчении симптомов ПТСР, БДР и тревожных расстройств.
• 1. GBD 2019 Mental Disorders Collaborators. Global, regional, and national burden of 12 mental disorders in 204 countries and territories, 1990–2019: a systematic analysis for the Global Burden of Disease Study 2019. Lancet Psychiatry 2022; 9: 137-50.
• 2. van Praag HM. Can stress cause depression? Prog Neuropsychopharmacol Biol Psychiatry 2004; 28: 891-907.
• 3. Shin LM, Liberzon I. The neurocircuitry of fear, stress, and anxiety disorders. Neuropsychopharmacol 2010; 35: 169-91.
• 4. De Filippo C, Cavalieri D, Di Paola M, Ramazzotti M, Poullet JB, Massart S, et al. Impact of diet in shaping gut microbiota revealed by a comparative study in children from Europe and rural Africa. Proc Natl Acad Sci USA 2010; 107: 14691-6.
• 5. Schnorr SL, Candela M, Rampelli S, Centanni M, Consolandi C, Basaglia G. Gut microbiome of the Hadza hunter-gatherers. Nat Commun 2014; 5: 3564.
• 6. Ayeni FA, Biagi E, Rampelli S, et al. Infant and Adult Gut Microbiome and Metabolome in Rural Bassa and Urban Settlers from Nigeria. Cell Rep 2018; 23: 3056-67.
• 7. Clarke G, Grenham S, Scully P, et al. The microbiome-gut-brain axis during early life regulates the hippocampal serotonergic system in a sex-dependent manner. Molecular Psychiatry 2013; 18: 666-73.
• 8. Desbonnet L, Garrett L, Clarke G, Kiely B, Cryan JF, Dinan TG. Effects of the probiotic Bifidobacterium infantis in the maternal separation model of depression. Neuroscience 2010; 170: 1179-88.
• 9. Sudo N, Chida Y, Aiba Y, Sonoda J, Oyama N, Yu XN. Postnatal microbial colonization programs the hypothalamic-pituitary-adrenal system for stress response in mice. J Physiol 2004; 558: 263-75.
• 10. Bercik P, Denou E, Collins J, et al. The intestinal microbiota affect central levels of brain-derived neurotropic factor and behavior in mice. Gastroenterology 2011; 141: 599-609.
• 11. Kelly JR, Borre Y, O’ Brien C, Patterson E, El Aidy S, Deane J, et al. Transferring the blues: Depression-associated gut microbiota induces neurobehavioural changes in the rat. J Psychiatr Res 2016; 82: 109-18.
• 12. Liu S, Guo R, Liu F, Yuan Q, Yu Y, Ren F. Gut microbiota regulates depression-like behavior in rats through the neuroendocrine-immune-mitochondrial pathway. Neuropsychiatr Dis Treat 2020; 16: 859-69.
• 13. Zheng P, Zeng B, Zhou C, et al. Gut microbiome remodeling induces depressive-like behaviors through a pathway mediated by the host’s metabolism. Mol Psychiatry 2016; 21: 786-96.
• 14. Hoke A, Chakraborty N, Gautam A, Hammamieh R, Jett M. Acute and delayed effects of stress eliciting post-traumatic stress-like disorder differentially alters fecal microbiota composition in a male mouse model. Front Cell Infect Microbiol 2022; 12: 810815.
• 15. Pascual Cuadrado D, Todorov H, Lerner R, et al. Long-term molecular differences between resilient and susceptible mice after a single traumatic exposure. Br J Pharmacol 2022; 179: 4161-80.
• 16. Malan-Muller S, Valles-Colomer M, Foxx CL, et al. Exploring the relationship between the gut microbiome and mental health outcomes in a posttraumatic stress disorder cohort relative to trauma-exposed controls. Eur Neuropsychopharmacol 2022; 56: 24-38.
• 17. Simpson CA, Diaz-Arteche C, Eliby D, Schwartz OS, Simmons JG, Cowan CSM. The gut microbiota in anxiety and depression - A systematic review. Clin Psychol Rev 2021;83: 101943.
• 18. Alli SR, Gorbovskaya I, Liu JCW, Kolla NJ, Brown L, Müller DJ. The gut microbiome in depression and potential benefit of prebiotics, probiotics and synbiotics: a systematic review of clinical trials and observational studies. Int J Mol Sciences 2022; 23: 4494.
• 19. Ra Y, Eu P, Ev V, Mv O, Mv M, Gi K, et al. A Multi-strain potential probiotic formulation of GABA-producing Lactobacillus plantarum 90sk and Bifidobacterium adolescentis 150 with antidepressant effects. Probiotics and Antimicrobial Proteins 2020; 12: 973-9.







