Microbiota intestinal e perturbações relacionadas com o stress
Síntese
Pela Prof. Sian M. J. Hemmings
Departamento de Psiquiatria, Faculdade de Medicina e Ciências da Saúde, Universidade de Stellenbosch, Tygerberg, África do Sul
Área para o público geral
Encontre aqui o seu espaço dedicado
en_sources_title
en_sources_text_start en_sources_text_end
Capítulos

Sobre este artigo
As perturbações relacionadas com o stress, incluindo as perturbações de stress pós-traumático (PSPT), as perturbações de ansiedade e as principais perturbações depressivas (MDD), são perturbações psiquiátricas comuns com uma resposta disfuncional ao stress um mecanismo patogénico chave. Estas perturbações são altamente complexas e debilitantes, estão associadas a um aumento da mortalidade e morbilidade. Existem provas consideráveis que implicam o papel da microbiota intestinal nas perturbações psiquiátricas, incluindo as perturbações relacionadas com o stress. Delinear um perfil microbiano intestinal específico associado ao desenvolvimento de perturbações psiquiátricas pode facilitar a identificação de biomarcadores fiáveis de risco associado à doença e prever a predisposição para desenvolver tais perturbações. Além disso, a microbiota intestinal pode ser facilmente manipulada e pode, portanto, oferecer uma opção de tratamento simples e sustentável para aliviar os sintomas das perturbações relacionadas com o stress. Este artigo analisa a literatura atual sobre o eixo microbioma-intestino-cérebro, e como este sistema bidirecional de comunicação pode desempenhar um papel na etiologia do PSPT, MDD e distúrbios de ansiedade.
PERTURBAÇÕES RELACIONADAS COM O STRESS
As perturbações psiquiátricas são perturbações crónicas e debilitantes que prejudicam significativamente o funcionamento diário, e estão entre as dez principais causas de carga da doença a nível mundial [1]. A exposição a fatores de stress e trauma ambientais está associada ao aumento da incidência de transtorno de stress pós-traumático (PSPT), transtorno depressivo importante (MDD) e transtornos de ansiedade [2, 3]. Estas perturbações relacionadas com o stress estão associadas ao aumento da mortalidade, à redução da esperança de vida, são altamente comórbidas, e apresentam uma resposta variável à farmacoterapia de primeira linha. Não existem biomarcadores clinicamente acionáveis para estas perturbações, complicando ainda mais o seu diagnóstico e tratamento. Para facilitar o desenvolvimento de novas estratégias terapêuticas e potenciais intervenções, é imperativo que obtenhamos uma visão mais profunda dos mecanismos biológicos subjacentes a estas perturbações.
O EIXO MICROBIOMA- GUT-BRAIN (MGB, MICROBIOMA- INTESTINO-CÉREBRO)
“Microbiota” é o termo que se refere aos triliões de microrganismos que vivem dentro e sobre nós. O catálogo completo destes microrganismos e dos seus genes constitui o microbioma humano. O microbioma intestinal, crucial na manutenção de numerosos aspetos do nosso funcionamento fisiológico, é um sistema dinâmico, cuja composição é afetada por numerosos fatores, incluindo a genética do hospedeiro, idade, dieta e etnia [4-6]. O eixo microbioma-intestino-cérebro (MGB) é um sistema complexo e bidirecional de comunicação entre o microbioma intestinal, o intestino, e o sistema nervoso central (SNC), facilitado por vias de comunicação diretas e indiretas (Figura 1).
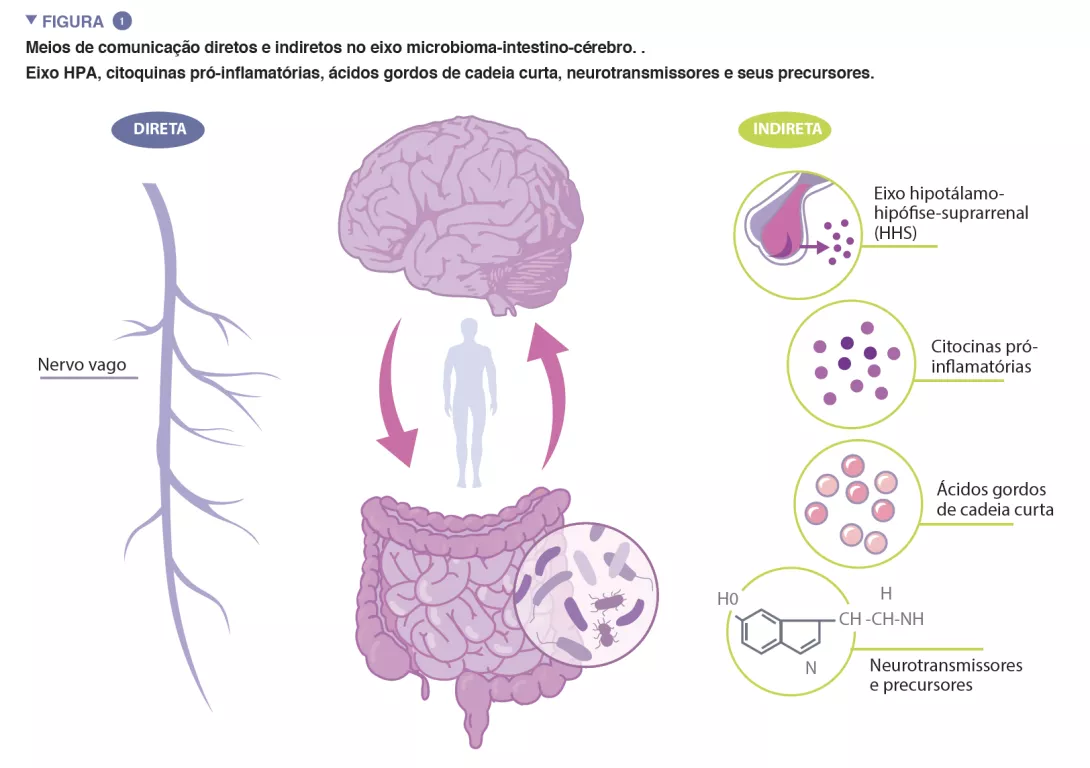
O nervo vago, o principal nervo parassimpático do sistema nervoso autónomo, representa uma ligação direta entre o intestino e o cérebro, com aferentes e eferentes vagais facilitando a interação recíproca entre o sistema nervoso entérico e o cérebro. A comunicação indireta dentro do eixo MGB assume muitas formas. A microbiota produz várias moléculas derivadas de micróbios, incluindo neurotransmissores e metabolitos, que atuam em múltiplos locais do corpo. Muitas destas moléculas, incluindo a serotonina (5-HT), foram encontradas para regular o comportamento, função cerebral e saúde. Até 95% da 5-HT no corpo é produzida nas células enterocromafínicas que revestem o intestino, e os níveis de 5-HT no intestino são influenciados por metabolitos microbianos, incluindo o indole, ácidos biliares e ácidos gordos de cadeia curta (SCFA). A 5-HT produzida no intestino não pode ultrapassar a barreira hematoencefálica (BHE) e, portanto, não pode afetar os níveis de 5-HT no cérebro. No entanto, estudos com animais fornecem evidências que sugerem que os níveis do precursor de 5-HT, triptofano, modulado por certas bactérias intestinais, estão associados à regulação da neurotransmissão de 5-HT no cérebro [7].
Verificou-se que as alterações nos SCFA, um produto da fermentação bacteriana dos polissacáridos indigeríveis do hospedeiro, foram associadas à exposição ao stress crónico e ao comportamento depressivo em estudos com animais. Os SCFA estão envolvidos numa série de funções reguladoras, incluindo a modulação da atividade intestinal e integridade intestinal, e a activação de microglia (células imunes inatas no cérebro, que desempenham um papel importante na regulação da sobrevivência e respostas neuronais). Os SCFA são capazes de atravessar a BHE, e ao fazê-lo, podem afetar a função cerebral.
Está bem estabelecido que o microbioma intestinal desempenha um papel importante no desenvolvimento tanto do sistema imunitário periférico como do sistema imunitário central, e a acumulação de provas sugere que o aumento da inflamação está associado a perturbações relacionadas com o stress. Um desequilíbrio na composição microbiana intestinal pode comprometer a integridade do epitélio intestinal [8], aumentando a permeabilidade intestinal e facilitando a translocação de bactérias, ou componentes bacterianos, através da barreira epitelial para a circulação sistémica. Isto promove uma inflamação de baixo grau, que estimula uma maior expressão de citocinas pró-inflamatórias. As citocinas pró-inflamatórias podem estimular o eixo hipotálamo-hipófise suprarrenal (HPA) para segregar o cortisol, o que pode aumentar ainda mais a permeabilidade intestinal. De facto, foram relatadas evidências de disfunção do intestino e da barreira cerebral em perturbações relacionadas com o stress.
A administração sistémica de lipopolissacáridos (LPS), um componente importante da membrana externa das bactérias gram-negativas, resultou em ansiedade aguda e aumento de sintomas de tipo depressivo, bem como défices cognitivos, e verificou-se que o aumento dos níveis de citocinas próinflamatórias induzido pelo LPS alterou a atividade neuronal em áreas límbicas do cérebro. Verificou-se também que o LPS induziu um aumento da produção de citocinas no SNC, comprometendo a integridade da BHE, resultando num “cérebro com fugas”.
INVESTIGAÇÃO DO MICROBIOMA INTESTINAL EM DOENÇAS RELACIONADAS COM O STRESS: RESULTADOS PRÉ-CLÍNICOS E CLÍNICOS
Várias investigações pré-clínicas apoiam a ideia de que a composição microbiana intestinal está associada a perturbações relacionadas com o stress. As investigações que utilizam animais sem germes (GF, microbiologicamente estéreis) têm desempenhado um papel crucial na nossa compreensão do eixo MGB. Na sua investigação seminal, Sudo e colegas [9] observaram uma resposta exagerada ao stress, evidenciada pelo aumento dos níveis de corticosterona, em ratos GF, em comparação com os controlos, na sequência de stress agudo de contenção. Esta resposta exagerada do eixo HPA ao stress foi normalizada na mono-colonização dos ratos GF com Bifidobacterium infantum. Estudos demonstraram também que é possível transferir fenótipos comportamentais de ansiedade entre duas estirpes de ratos, por meio de transplante de microbiota fecal (FMT) [10]. Do mesmo modo, vários estudos relataram o desenvolvimento de comportamentos depressivos e ansiosos, e de vias neuroendócrinas alteradas, em roedores com microbiota, após FMT de humanos diagnosticados com MDD, sugerindo um papel causal para a microbiota intestinal em comportamentos depressivos [11-13]. Estudos com animais também demonstraram que a exposição ao stress pode causar alterações duradouras no microbioma intestinal - dois estudos recentes relataram a diminuição da abundância relativa de Akkermansia muciniphila no microbioma intestinal de animais stressados ao longo do tempo, em comparação com animais de controlo [14, 15]. A. muciniphila e a camada externa da membrana da bactéria (Amuc_1100) foram considerados como melhorando o comportamento depressivo, e aumentando os níveis circulatórios de 5-HT.
Comparativamente, poucos estudos clínicos foram realizados para determinar a associação entre o microbioma intestinal e as perturbações relacionadas com o stress. Até agora, os únicos dados publicados sobre o microbioma intestinal no PSPT emanam do nosso grupo de investigação [16], onde foi encontrado um consórcio de quatro géneros bacterianos para prever o estado do PSPT com 66,4% de exatidão. Além disso, verificou-se que o diagnóstico MDD na amostra estava associado ao aumento da abundância relativa do filo Bacteroidetes. Outros estudos indicam que os taxa bacterianos associados tanto à depressão como às perturbações de ansiedade se caracterizam por uma maior abundância relativa de taxa que induzem um ambiente pró-inflamatório e uma reduzida abundância de bactérias produtoras de SCFA [17].
O campo da investigação está, no entanto, ainda na sua infância, atualmente limitado pela falta de normalização na análise microbiológica intestinal, desde a recolha de amostras aos métodos analíticos. Em muitos casos, fatores que podem confundir os resultados, incluindo dieta, uso de medicamentos, etnia e genética do hospedeiro, não foram tidos em conta nos estudos analisados acima. Além disso, a maioria dos estudos realizados foram transversais na conceção, limitando a nossa capacidade de separar as causas das consequências, e muito poucos investigaram mecanismos potenciais subjacentes às associações.
A. muciniphila é uma bactéria anaeróbica gram-negativa, encontrada principalmente na mucosa intestinal, e desempenha um papel na manutenção da integridade da barreira intestinal, bem como na regulação imunológica e metabólica.
MODULAÇÃO DO EIXO MGB: PROBIÓTICOS
O microbioma intestinal é rastreável e tem o potencial de ser modulado, tornando a procura de marcadores microbiológicos intestinais associados a perturbações relacionadas com o stress particularmente atrativa. Os probióticos são definidos como microrganismos vivos que, quando administrados em quantidades adequadas, conferem um benefício para a saúde do hospedeiro; os psicobióticos referem-se aos probióticos que conferem um benefício para a saúde mental, cognição e comportamento. Publicações recentes indicaram efeitos benéficos moderados dos psicobióticos no alívio de sintomas depressivos e de ansiedade, tanto em coortes saudáveis como em coortes clinicamente definidas [18]. No entanto, é importante manter-se cauteloso na interpretação dos resultados dos estudos atuais, uma vez que são variáveis no que diz respeito à formulação e dosagem probiótica, características da amostra (fenótipo clínico e gravidade da depressão/ansiedade), e tempo de seguimento. Além disso, o benefício dos psicobióticos sobre, e as interações com, os medicamentos antidepressivos ainda não foi extensivamente investigado, embora alguns resultados intrigantes de estudos pré-clínicos sugiram que certos probióticos, quando administrados em formato multi-estirpe, possuem efeitos antidepressivos semelhantes aos, e por vezes com maior efeito do que os atuais antidepressivos de primeira linha [19]. Tais psicóticos, quando usados em conjunto com antidepressivos, podem ter uma utilização particular em indivíduos com depressão resistente ao tratamento.
Conclusão
As provas que sugerem que o microbioma intestinal é alterado em doenças relacionadas com o stress continuam a crescer, e embora ainda haja muito trabalho a fazer no terreno, delinear um perfil microbiano intestinal específico associado ao desenvolvimento de doenças relacionadas com o stress pode facilitar a identificação de biomarcadores fiáveis de risco associado à doença e prever a predisposição para desenvolver essas doenças. O microbioma intestinal pode ser facilmente manipulado e pode, portanto, oferecer uma opção de tratamento simples e sustentável para aliviar os sintomas de PSPT, MDD e distúrbios de ansiedade.
• 1. GBD 2019 Mental Disorders Collaborators. Global, regional, and national burden of 12 mental disorders in 204 countries and territories, 1990–2019: a systematic analysis for the Global Burden of Disease Study 2019. Lancet Psychiatry 2022; 9: 137-50.
• 2. van Praag HM. Can stress cause depression? Prog Neuropsychopharmacol Biol Psychiatry 2004; 28: 891-907.
• 3. Shin LM, Liberzon I. The neurocircuitry of fear, stress, and anxiety disorders. Neuropsychopharmacol 2010; 35: 169-91.
• 4. De Filippo C, Cavalieri D, Di Paola M, Ramazzotti M, Poullet JB, Massart S, et al. Impact of diet in shaping gut microbiota revealed by a comparative study in children from Europe and rural Africa. Proc Natl Acad Sci USA 2010; 107: 14691-6.
• 5. Schnorr SL, Candela M, Rampelli S, Centanni M, Consolandi C, Basaglia G. Gut microbiome of the Hadza hunter-gatherers. Nat Commun 2014; 5: 3564.
• 6. Ayeni FA, Biagi E, Rampelli S, et al. Infant and Adult Gut Microbiome and Metabolome in Rural Bassa and Urban Settlers from Nigeria. Cell Rep 2018; 23: 3056-67.
• 7. Clarke G, Grenham S, Scully P, et al. The microbiome-gut-brain axis during early life regulates the hippocampal serotonergic system in a sex-dependent manner. Molecular Psychiatry 2013; 18: 666-73.
• 8. Desbonnet L, Garrett L, Clarke G, Kiely B, Cryan JF, Dinan TG. Effects of the probiotic Bifidobacterium infantis in the maternal separation model of depression. Neuroscience 2010; 170: 1179-88.
• 9. Sudo N, Chida Y, Aiba Y, Sonoda J, Oyama N, Yu XN. Postnatal microbial colonization programs the hypothalamic-pituitary-adrenal system for stress response in mice. J Physiol 2004; 558: 263-75.
• 10. Bercik P, Denou E, Collins J, et al. The intestinal microbiota affect central levels of brain-derived neurotropic factor and behavior in mice. Gastroenterology 2011; 141: 599-609.
• 11. Kelly JR, Borre Y, O’ Brien C, Patterson E, El Aidy S, Deane J, et al. Transferring the blues: Depression-associated gut microbiota induces neurobehavioural changes in the rat. J Psychiatr Res 2016; 82: 109-18.
• 12. Liu S, Guo R, Liu F, Yuan Q, Yu Y, Ren F. Gut microbiota regulates depression-like behavior in rats through the neuroendocrine-immune-mitochondrial pathway. Neuropsychiatr Dis Treat 2020; 16: 859-69.
• 13. Zheng P, Zeng B, Zhou C, et al. Gut microbiome remodeling induces depressive-like behaviors through a pathway mediated by the host’s metabolism. Mol Psychiatry 2016; 21: 786-96.
• 14. Hoke A, Chakraborty N, Gautam A, Hammamieh R, Jett M. Acute and delayed effects of stress eliciting post-traumatic stress-like disorder differentially alters fecal microbiota composition in a male mouse model. Front Cell Infect Microbiol 2022; 12: 810815.
• 15. Pascual Cuadrado D, Todorov H, Lerner R, et al. Long-term molecular differences between resilient and susceptible mice after a single traumatic exposure. Br J Pharmacol 2022; 179: 4161-80.
• 16. Malan-Muller S, Valles-Colomer M, Foxx CL, et al. Exploring the relationship between the gut microbiome and mental health outcomes in a posttraumatic stress disorder cohort relative to trauma-exposed controls. Eur Neuropsychopharmacol 2022; 56: 24-38.
• 17. Simpson CA, Diaz-Arteche C, Eliby D, Schwartz OS, Simmons JG, Cowan CSM. The gut microbiota in anxiety and depression - A systematic review. Clin Psychol Rev 2021;83: 101943.
• 18. Alli SR, Gorbovskaya I, Liu JCW, Kolla NJ, Brown L, Müller DJ. The gut microbiome in depression and potential benefit of prebiotics, probiotics and synbiotics: a systematic review of clinical trials and observational studies. Int J Mol Sciences 2022; 23: 4494.
• 19. Ra Y, Eu P, Ev V, Mv O, Mv M, Gi K, et al. A Multi-strain potential probiotic formulation of GABA-producing Lactobacillus plantarum 90sk and Bifidobacterium adolescentis 150 with antidepressant effects. Probiotics and Antimicrobial Proteins 2020; 12: 973-9.





