Efecto inmunorregulador dependiente de la cepa de hongo en las enfermedades inflamatorias intestinales crónicas
Artículo comentado - adulto
Por el Prof. Harry Sokol
Gastroenterology and Nutrition Department, Saint-Antoine Hospital, Paris, France
Espacio para el público general
Encuentra aquí tu espacio dedicado
en_sources_title
en_sources_text_start en_sources_text_end
Capítulos

Acerca de este artículo
Autor
Comentario sobre el artículo de Li XV et al. Nature 2022 [1]
La microbiota fúngica (micobiota) forma parte de la compleja comunidad microbiota que coloniza el tracto gastrointestinal de los mamíf eros y desempeña una importante función en la regulación inmunitaria. Aunque se han relacionado alteraciones en la micobiota con diferentes enfermedades, como las enfermedades inflamatorias intestinales crónicas (EIIC), actualmente se desconoce si las especies de hongos identificadas por secuenciac ión representan organismos vivos y si los hongos específicos influyen en la apari ción de las EIIC. Los autores han desarrollado una plataforma traslacional para el análisis funcional de la micobiota. Mediante la combinación de la secuenciación de alta resolución de la micobiota, la culturómica y la genómica fúngicas, un sistema de edición de cepas fúngicas basado en CRISPR-Cas9, prueba de inmunorreactividad funcional in vitro y modelos in vivo, esta plataforma permite examinar las interacciones huésped-hongo en el intestino humano. Hemos observado una rica diversidad genética de cepas oportunistas de Candida albicans que dominan la mucosa colónica de pacientes con EIIC. Entre estas muestras, las cepas con una gran capacidad para dañar las células inmunitarias (cepas H D) reflejan las características de la enfermedad de pacientes con colitis ulcer osa y empeoran la inflamación intestinal in vivo a través de mecanismos dependientes de la IL-1 β. La respuesta inflamatoria y antifúngica de los linfocitos T auxiliares productores de interleucina-17A (linfocitos T H17) inducida por cepas de EH en el intestino dependía de la candidalisina, una toxina peptídica secretada por C. albicans, durante la transición de un estado comensal benigno a un estado de patobionte. Estos resultados revelan la especificidad de cepa en las interac ciones anfitriónhongo en el intestino humano y apuntan a nuevos objetivos diagnósticos y terapéuticos para las EIIC.
¿QUÉ SE SABE YA SOBRE ESTE TEMA?
Existen estudios basados en una secuenciación profunda de la micobiota intestinal en varias cohortes de enfermedades que aportan pruebas consistentes de que la “disbiosis fúngica” es una característica de las enfermedades intestinales inflamatorias crónicas (EIIC) [2], cuyas formas más comunes son la enfermedad de Crohn (EC) y la colitis ulcerosa (CU), que afectan a millones de personas en todo el mundo. Los anticuerpos anti-Saccharomyces cerevisiae (ASCA), dirigidos contra el manano de la pared de los hongos, definen los subtipos de EIIC, ya que su presencia en el suero sanguíneo se asocia a la EC pero no a la CU, lo que establece una conexión adicional entre los hongos y las EIIC. Candida es el género fúngico más prevalente, y su presencia aumenta sistemáticamente en numerosas cohortes de pacientes con EIIC analizadas mediante la secuenciación de la microbiota fecal [2].
En concreto, C. albicans en el intestino produce un conjunto de anticuerpos antifúngicos y actúa como un inmunógeno para los ASCA. Los macrófagos que residen en el intestino detectan las especies de Candida asociadas a la mucosa intestinal y, por lo tanto, tienen la capacidad de inducir una inmunidad protectora o de desencadenar una inflamación en función del contexto, de forma experimental [3]. A pesar de estas pruebas, por el momento se desconoce si los hongos detectados gracias a las tecnologías de secuenciación en la mucosa intestinal humana desempeñan una función clave en la orientación de la inmunidad de la mucosa o en la evolución de la enfermedad inflamatoria en cada paciente. Se ha observado en numerosas ocasiones una falta de asociación entre los cambios en la composición de la micobiota y la gravedad de la enfermedad en cohortes de pacientes con EIIC, a pesar de un aumento constante de las especies de Candida. Esto ha llevado a los autores a plantear la hipótesis de que la diversidad funcional de las cepas de Candida determina la relación anfitrión-hongo en la mucosa intestinal humana y tiene un efecto sobre la inflamación intestinal.
PUNTOS CLAVE
- La micobiota está alterada en pacientes con EIIC y Candida albicans tiene efectos proinflamatorios
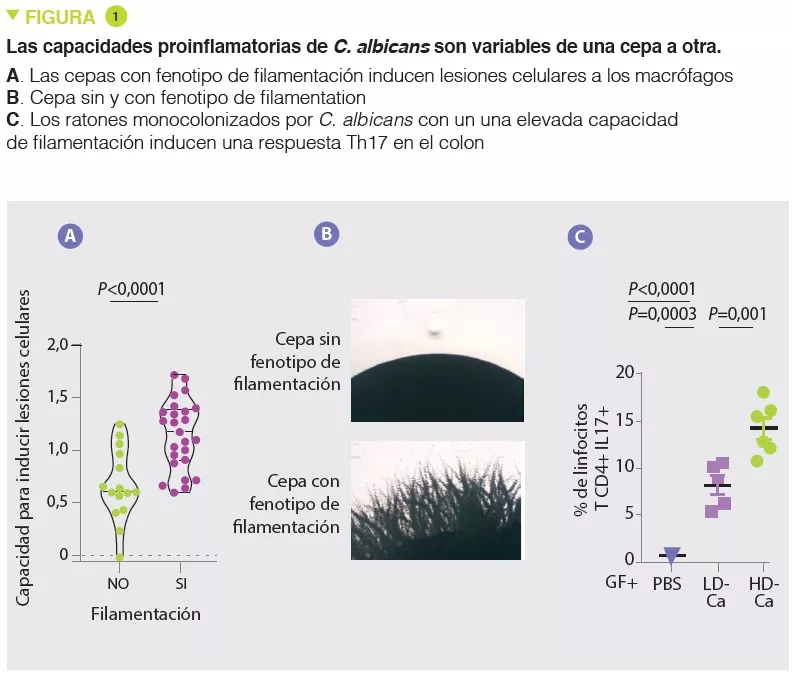
- Los efectos proinflamatorios de C. albicans varían de una cepa a otra, y están asociados a la capacidad de inducir lesiones celulares en los macrófagos y en los filamentos
- Los efectos proinflamatorios de estas cepas de C. albicans están causados por la producción de candidalisina y una inducción de la producción de IL-1β
- C. albicans, la candidalisina y la IL-1β son posibles
CUÁLES SON LOS PRINCIPALES RESULTADOS APORTADOS POR ESTE ESTUDIO?
En concordancia con muchos otros estudios, los autores observaron, en primer lugar, que la micobiota de pacientes con CU era más rica en Candida albicans y, por el contrario, más pobre en Saccharomyces. En una situación de alteración de la respuesta inmunitaria causada por un tratamiento con corticosteroides, C. albicans empeora la gravedad de la colitis en ratones. En segundo lugar, los autores aislaron varias cepas de C. albicans a partir de la micobiota de personas sanas y de pacientes con CU y observaron una gran heterogeneidad en cuanto a la capacidad proinflamatoria. En concreto, la capacidad de infligir daños celulares a los macrófagos, que constituyen una línea clave de defensa contra los hongos, es variable de una cepa a otra. Las cepas capaces de infligir daño celular a los macrófagos presentan una mayor tendencia a tener filamentos y tienen efectos proinflamatorios in vivo al inducir una respuesta Th17 (Figura 1). Entonces, los autores demostraron que gran parte de estos efectos proinflamatorios estaban favorecidos por la secreción de una toxina, la candidalisina, y la inducción de la producción de IL-1β. Los análisis posteriores revelaron una notable correlación entre la capacidad proinflamatoria de las cepas aisladas de pacientes con CU y la actividad inflamatoria de la enfermedad. En cambio, no había correlación entre el nivel de inflamación intestinal y la abundancia general de Candida albicans en los pacientes. Estos resultados explican por qué la composición de la micobiota se correlaciona mal con las características de las patologías humanas y sugieren que las capacidades funcionales (en este caso, las proinflamatorias) podrían explicar mejor la contribución de la micobiota en estas patologías.
¿CUÁLES SON LAS CONSECUENCIAS EN LA PRÁCTICA?
Este estudio demuestra que, además del análisis de la composición de la micobiota, especialmente mediante secuenciación, es necesario un análisis funcional para comprender su contribución a la patología y, en particular, a las EIIC. Si se confirma el papel de las cepas proinflamatorias de C. albicans, la candidalisina y la IL-1β en la CU, es plausible que uno de estos elementos se convierta en una diana terapéutica, sobre todo porque ya hay varias moléculas disponibles para antagonizar la vía de la IL-1β.
Conclusión
Este estudio sugiere que la candidalisina es un determinante clave del efecto proinflamatorio de C. albicans en el intestino, y que las cepas con alta capacidad proinflamatoria actúan a través de mecanismos dependientes de la IL-1β. Es posible que los pacientes portadores de cepas con una gran capacidad proinflamatoria representen una población objetivo de un tratamiento de bloqueo de la IL-1β y/o de C. albicans.
1. Li XV, Leonardi I, Putzel GG, et al. Immune regulation by fungal strain diversity in inflammatory bowel disease. Nature 2022 ; 603 : 672-8.
2. Sokol H, Leducq V, Aschard H, et al. Fungal microbiota dysbiosis in IBD. Gut 2017 ; 66 : 1039-48.
3. Doron I, Leonardi I, Li XV, et al. Human gut mycobiota tune immunity via CARD9-dependent induction of anti-fungal IgG antibodies. Cell 2021 ; 184 : 1017-1031.e14.






