Temps forts du 54e congrès de l'ESPGHAN
RETOUR DE CONGRES
Par le Pr Koen Huysentruyt
Gastro-entérologie, hépatologie et nutrition pédiatriques, Centre pédiatrique de Bruxelles pour la réhabilitation intestinale (Brussels Centre for Intestinal Rehabilitation in Children, B-CIRC), Belgique
Section grand public
Retrouvez ici votre espace dédié
en_sources_title
en_sources_text_start en_sources_text_end
Chapitres

A propos de cet article
Le 54e congrès annuel de l’ESPGHAN s’est tenu du 22 au 25 juin 2022 dans la belle ville de Copenhague. C’était la première fois que le congrès avait lieu de nouveau en présentiel après deux années de restrictions dues à la pandémie de Covid. Ce fut une excellente occasion de rencontrer des experts en gastro-entérologie, hépatologie et nutrition pédiatriques du monde entier pour partager les connaissances, les recherches et de nouvelles idées intéressantes. Le but de cet article est de mettre en lumière quelques-uns des thèmes abordés concernant le microbiome.
LE VIROME
Le Pr Dennis Sandris Nielsen nous a présenté le virome, un ensemble de virus que nous portons, qui est un domaine de recherche émergent qui semble jouer un rôle important dans la santé et les maladies humaines. L’analyse d’échantillons fécaux montre qu’environ 6 % de l’ADN retrouvé n’est pas d’origine bactérienne, mais d’origine virale. Pour chaque bactérie présente dans le corps humain, un virus lui correspond. Comme le microbiome, le virome est influencé par des facteurs pré-, péri- et post-natals (alimentation, environnement, fratrie, médicaments, etc.). Ces virus sont donc omniprésents dans l’intestin et jouent un rôle clé dans la régulation du microbiome intestinal. Les bactériophages sont un type de virus qui s’attaquent aux bactéries d’une manière spécifique à l’hôte. Deux types différents d’interactions sont décrits : la dynamique « kill the winner (tuer le vainqueur) » et la dynamique « piggyback the winner (sur les épaules du vainqueur) ». Selon la première dynamique, les bactériophages attaquent la bactérie, injectent leur ADN et utilisent la bactérie comme hôte pour créer de nouvelles particules phagiques après la lyse de la cellule. L’orateur fait une analogie avec les lions et les gazelles dans la savane, soit une dynamique de diversité constante, la destruction des concurrents de niche, le shunt ou court-circuit phagique et le renouvellement bactérien et la pression sur l’hôte pour la diversification des récepteurs de phages. Selon la seconde dynamique, le virus accompagne le vainqueur, en intégrant son ADN dans le génome de la bactérie, en modifiant la cellule hôte et en la rendant plus efficace, faisant ainsi du vainqueur un vainqueur. Une étude sur les échantillons fécaux d’une population de nourrissons en bonne santé au Danemark a identifié plus de 10 000 espèces virales appartenant à 248 familles virales. Fait notable, 232 de ces familles n’avaient pas été décrites auparavant, ce qui conforte l’hypothèse selon laquelle seule la partie émergée de l’iceberg a jusqu’à présent été découverte [1]. Les questions posées sont celles de l’implication sur la santé humaine et du rôle éventuel dans la maturation du système immunitaire. Le déséquilibre du virome intestinal pourrait jouer un rôle dans le développement de maladies (comme les MICI à début très précoce, l’ECN, etc.).
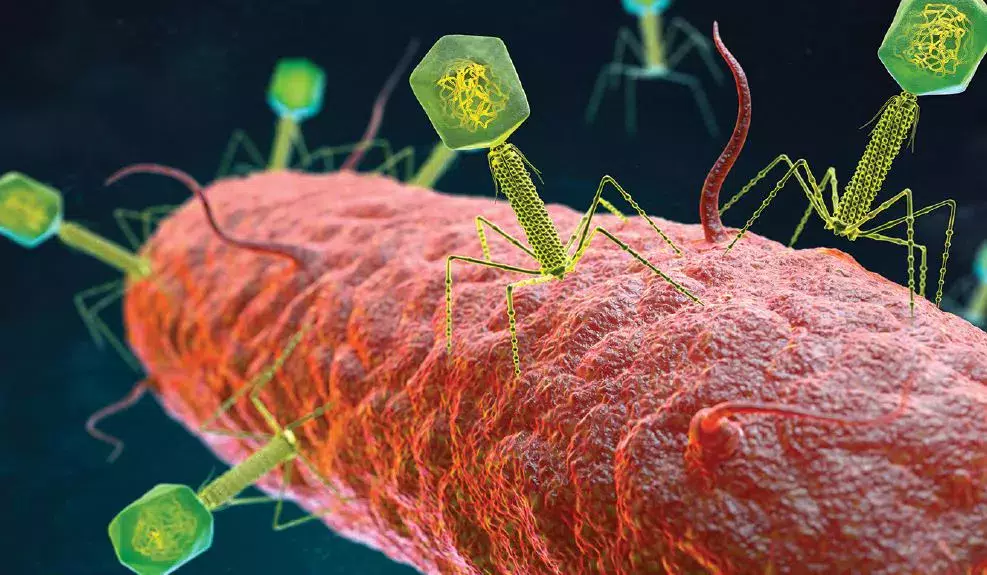
CÉSARIENNE ET MICROBIOME
Le mode d’accouchement joue un rôle clé dans la formation précoce du microbiome intestinal. Les bébés nés par voie vaginale sont exposés à des souches bactériennes différentes de celles auxquelles sont exposés les bébés nés par césarienne, avec pour conséquence une colonisation différente. De plus, la réalisation d’une césarienne est le plus souvent due à une urgence foetale. Ces bébés sont plus susceptibles d’avoir un pH du sang ombilical faible, ce qui entraîne une réduction de la perméabilité des jonctions serrées et favorise la dysbiose.
L’allaitement maternel semble contrecarrer l’effet délétère de la césarienne sur le microbiote et reste la référence en matière de nutrition infantile. Toutefois, les femmes qui accouchent par césarienne sont moins susceptibles d’allaiter ou bien elles débutent l’allaitement plus tardivement et les nourrissons sont alors nourris au lait maternisé. C’est pourquoi les chercheurs sont constamment à la recherche du cocktail parfait de pré, pro, syn ou postbiotiques permettant de mimer le microbiome intestinal d’un nourrisson allaité.
Le Dr Eduardo López-Huertas a parlé d’une souche de Lactobacillus fermentum et montré des résultats prometteurs chez des nourrissons nés par césarienne. Dans le cadre d’un essai contrôlé randomisé (ECR), les auteurs ont analysé les échantillons de selles de nourrissons nourris avec une formule symbiotique contenant L. fermentum et des GOS et ils ont trouvé des ressemblances majeures avec les échantillons fécaux de nourrissons allaités (plus de bifidobactéries, pH fécal plus faible) [2]. En outre, une méta- analyse récente (3 essais) a montré que L. fermentum réduisait l’incidence des infections gastro-intestinales de 73 % chez les nourrissons nés par césarienne. Des recherches supplémentaires sont nécessaires pour étudier les avantages possibles dans la prévention de maladies potentielles, comme les infections du tractus gastro-intestinal ou des voies respiratoires, en particulier chez les bébés nés par césarienne, qui ont un microbiome intestinal défavorable [3].
LES HMO DANS LES PRÉPARATIONS POUR NOURRISSONS ET LE MICROBIOME
Le Dr Giles Major nous a fait part de son point de vue sur le lien entre les glycanes et le microbiome intestinal. Les glycanes ou oligosaccharides du lait maternel (human milk oligosaccharides, HMO) affectent la composition globale du microbiome intestinal. Le lait maternel est composé de nombreux HMO différents dont la concentration dans le lait maternel varie en fonction de l’origine ethnique de la mère ainsi qu’au cours de la croissance de l’enfant. En étudiant le microbiome intestinal à un âge précoce, nous constatons une prédominance des bifidobactéries chez les nourrissons allaités par rapport aux nourrissons nourris au lait maternisé. Ces bifidobactéries sont importantes car elles absorbent du carbone et produisent des acides gras à chaîne courte qui modulent la perméabilité de la barrière intestinale. Leur source de carbone sont les HMO et le microbiome joue un rôle dans la digestion de ces HMO au travers de la présence de CAZymes. Ainsi, les CAZymes que vous possédez détermineront les glycanes que vous pourrez digérer et le type de glycanes dont un enfant est nourri orientera la maturation du microbiome au début de la vie.
Un ECR est conduit, dans lequel un groupe témoin de nourrissons nourris au lait maternisé est comparé à un groupe test recevant un mélange 5-HMO. L’essai est toujours en cours, mais les résultats préliminaires montrent que la diversité microbienne intestinale globale était significativement différente dans le groupe témoin par rapport au groupe test, dans lequel la composition du microbiome se rapprochait de celle des nourrissons allaités. L’orateur suggère que cela pourrait être la conséquence de la promotion des bifidobactéries, mais il ne s’agit pour l’instant que d’une hypothèse.







