КОММЕНСАЛЬНЫЕ ШТАММЫ CLOSTRIDIALES ОПОСРЕДУЮТ ЭФФЕКТИВНЫЙ ИММУННЫЙ ОТВЕТ ПРОТИВ СОЛИДНЫХ ОПУХОЛЕЙ
КОММЕНТАРИИ К СТАТЬЕ - РАЗДЕЛ, ПОСВЯЩЕННЫЙ ВЗРОСЛЫМ
Проф. Гарри Сокол (Harry Sokol)
Отделение гастроэнтерологии и нутрициологии, Больница Сен-Антуан, Париж, Франция
Раздел для широкой публики
Найдите здесь свое выделенное место
en_sources_title
en_sources_text_start en_sources_text_end
Делиться - значит заботиться
Возможно, эта тема заинтересует ваших коллег. Почему бы не поделиться ею?
Разделы
Об этой статье
Автор
Комментарии к статье Montalban-Arques et al. Cell Host & Microbe 2021 [1]
Несмотря на хорошие результаты, ингибиторы контрольных точек Т-клеток, применяемые для лечения онкологических заболеваний (противоопухолевая иммунотерапия), эффективны только у небольшой части пациентов. Недавно было обнаружено, что кишечная микробиота способна модулировать противоопухолевый иммунитет и ответ на лечение. Авторы статьи выявили штаммы Clostridiales микробиоты кишечника, ассоциированные с более низкой опухолевой нагрузкой в мышиных моделях колоректального рака (КРР). Интересно, что содержание этих комменсальных видов также значительно снижено у пациентов с КРР по сравнению со здоровыми людьми. Введение мышам через желудочный зонд комбинации из четырех штаммов Clostridiales (CC4) предотвращало возникновение и даже успешно излечивало КРР. Этот эффект зависел от инфильтрации опухоли иммунными клетками и активации CD8+ T-клеток. Введение только одного штамма Roseburia intestinalis или Anaerostipes caccae вызывало еще более выраженный эффект по сравнению с CC4. При прямом сравнении, комбинированная добавка CC4 превосходила терапию анти-PD-1 в мышиных моделях КРР и меланомы. Эти результаты обеспечивают надёжную доклиническую основу для дальнейшего изучения бактерий кишечника в качестве новой терапии солидных опухолей.
ЧТО МЫ УЖЕ ЗНАЕМ?
Кишечная микробиота играет важную роль в развитии иммунной системы и поддержании иммунного гомеостаза. Она влияет на иммунную систему как на местном, так и на системном уровне, поддерживая сбалансированный иммунный ответ. Показано, что при широком спектре заболеваний, таких как ожирение, хронические воспалительные заболевания кишечника, нервно-психические расстройства и колоректальный рак (КРР), происходит нарушение микробного баланса (дисбиоз).
КРР, одно из наиболее часто диагностируемых онкологических заболеваний, остается одной из основных причин смерти от онкологических заболеваний в мире и может быть связан как с образом жизни (диета, потребление табака и алкоголя), так и с факторами риска ожирения, каждый из которых ассоциируется с изменениями в составе микробиоты кишечника.
Кишечная микробиота пациентов с КРР отличается от микробиоты здоровых людей: в ней увеличено преобладание таксонов Bacteroides или Fusobacterium [2] и содержится меньше Clostridiales [3]. Большинство колоректальных опухолей обладают низкой иммуногенностью и, следовательно, не отвечают на иммунотерапию, активирующую Т-клетки. Анти-PD-1, анти-PD-L1 и/или анти-CTLA4 моноклональные антитела эффективны только у 4–5% пациентов с КРР с дефицитом репарации ошибочно спаренных оснований или высокой микросателлитной нестабильностью [4]. Недавние исследования показали, что некоторые представители микробиоты кишечника способны модулировать эффективность противоопухолевого лечения [5, 6]. В этом исследовании авторы оценивали способность комбинации четырех бактериальных штаммов, ассоциированных с низкой опухолевой нагрузкой в экспериментальной модели КРР, вызвать эффективный противоопухолевый иммунный ответ.
КЛЮЧЕВЫЕ МОМЕНТЫ
- Бактерии семейства Clostridiales ассоциируются с низкой опухолевой нагрузкой в мышиных моделях рака толстой кишки
- У пациентов с колоректальным раком снижено преобладание некоторых представителей семейства Clostridiales
- Комбинация четырех штаммов Clostridiales оказывает мощное противоопухолевое действие через CD8+ Т-клетки
- Введение Clostridiales мышам с солидными опухолями оказывает противоопухолевый эффект независимо от применения PD-1 иммунотерапии
ЧТО ГЛАВНОЕ В ЭТОМ ИССЛЕДОВАНИИ?
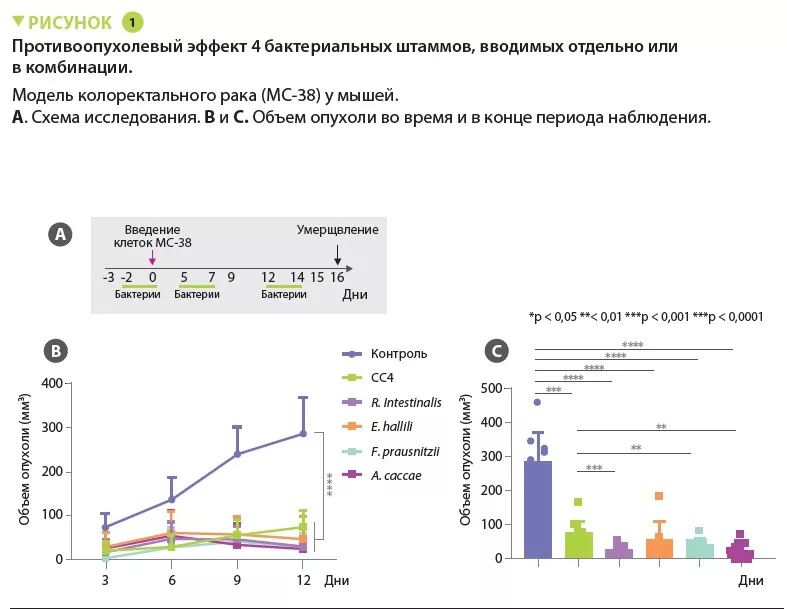
Исследователи отметили, что мыши с низким содержанием представителей Clostridiales (семейства Ruminococcaceae и Lachnospiraceae) в микробиоте имели повышенную восприимчивость к КРР. Исходя из этого, они выбрали комбинацию из четырех видов Clostridiales (CC4): Roseburia intestinalis, Eubacterium hallii (Anaerobutyricum hallii), Faecalibacterium prausnitzii и Anaerostipes caccae, численность которых снижается у пациентов с КРР, для проведения дополнительных оценок на мышиных моделях. Введение CC4 изменяло микробиоту мышей, приводя к увеличению преобладания видов из семейств Ruminococcaceae и Lachnospiraceae.
В нескольких моделях солидных опухолей (КРР, рак легкого и молочной железы) введение CC4 замедляло рост новообразований. Этот эффект был в основном опосредован лимфоцитами, поскольку исчезал у мышей с отсутствием зрелых лимфоцитов (мыши Rag2 KO). Основными мишенями являются интерферон-гамма-продуцирующие цитотоксические CD8+ Т-клетки, которые обильно инфильтрируют опухоль у животных, получающих CC4. Защитный эффект при КРР также наблюдался при применении каждого из бактериальных штаммов в отдельности, но с разной степенью эффективности (рисунок 1). Терапевтический эффект не был связан с бактериями, продуцирующими бутират.
Наконец, в модели КРР (MC-38) комбинация CC4 превосходила по эффективности анти-PD-1 иммунотерапию. Кроме того, аддитивный эффект не наблюдали у мышей, получавших иммунотерапию в сочетании с комбинацией четырех бактерий.
КАКОВЫ ПРАКТИЧЕСКИЕ ПОСЛЕДСТВИЯ?
Это исследование на мышиных моделях солидных опухолей показало, что, помимо адъювантного эффекта в иммунотерапевтическом лечении онкологических заболеваний, некоторые бактерии микробиоты оказывают собственный противоопухолевый эффект. Эти результаты открывают путь к разработке методов противоопухолевой терапии у человека с помощью воздействия на микробиоту кишечника. Новые методы лечения могут использоваться отдельно или в сочетании с другими «стандартными» подходами. Однако группы пациентов, которые могли бы получить наибольшую пользу от нового лечения, еще не определены.
ЗАКЛЮЧЕНИЕ
Результаты исследования показали, что штаммы Clostridiales, численность которых значительно снижается у пациентов с колоректальным раком, эффективно стимулируют противоопухолевый ответ в отношении солидных опухолей. Механизмы включают активацию CD8+ Т-клеток и не зависят от применения анти-PD-1 иммунотерапии.








