НОВОЕ В ИЗУЧЕНИИ ПРОБЛЕМ АУТИЗМА: РОЛЬ МИКРОБИОТЫ В СОЦИАЛЬНОЙ КОММУНИКАЦИИ
ОБЗОРНАЯ СТАТЬЯ
Д-р Винсент Требоссен (Vincent Trebossen)
Отделение детской и подростковой психиатрии, больница Робер-Дебре, APHP, Париж, Франция
Д-р Пьер Эллул (Pierre Ellul)
Отделение детской и подростковой психиатрии, больница Робер-Дебре, APHP, Отделение иммунологии, иммунопатологии и иммунотерапии, больница Питье-Сальпетриер, U959, Париж, Франция
Д-р Алексис Моска (Alexis Mosca)
Отделение детской гастроэнтерологии, больница Робер-Дебре, APHP, Париж, Франция
Проф. Ричард Делорм (Richard Delorme)
Отделение детской и подростковой психиатрии, Больница Робер-Дебре, APHP, Институт генетики и когнитивных функций человека при Институте Пастера, UMR3571 CNRS, Университет Париж-Сити, Париж, Франция
Раздел для широкой публики
Найдите здесь свое выделенное место
en_sources_title
en_sources_text_start en_sources_text_end
Делиться - значит заботиться
Возможно, эта тема заинтересует ваших коллег. Почему бы не поделиться ею?
Разделы

Об этой статье
Расстройства аутистического спектра (РАС) представляют собой сложные нарушения нервно-психического развития, поражающие 1% общей популяции и характеризующиеся дефицитом социального общения и повторяющимся/стереотипным поведением. Патофизиологические механизмы, лежащие в основе РАС, остаются малоизученными [1]. У 30–50% пациентов с РАС наблюдаются симптомы со стороны желудочно-кишечного тракта (ЖКТ), такие как боль в животе, диарея, запор, которые влияют на качество жизни и общее функционирование. Интересно, что частота возникновения и степень тяжести желудочно-кишечных симптомов сильно коррелируют с симптомами аутизма [2]. И хотя этиология желудочно-кишечных симптомов до сих пор неизвестна, исследования показали, что РАС может быть результатом дисбаланса в составе кишечной микробиоты (КМ) [3]. Все больше данных указывает на существование взаимосвязи между КМ и центральной нервной системой (ЦНС). КМ непосредственно влияет на нейрогенез, выживаемость нейронов, рост головного мозга, миелинизацию и другие процессы развития нервной системы. Модуляция КМ с помощью про- или пребиотиков, а также трансплантации фекальной микробиоты (ТФМ) у лиц с РАС вызывает благоприятные и долгосрочные эффекты в отношении желудочно-кишечных симптомов и основных симптомов аутизма. Однако необходимы более крупные двойные слепые рандомизированные исследования для подтверждения эффективности микробной терапии при РАС, особенно на ранних и критических этапах развития нервной системы.
МИКРОБИОТА КИШЕЧНИКА, ЦНС И РАЗВИТИЕ НЕРВНОЙ СИСТЕМЫ
Микробиота кишечника человека состоит примерно из 1013 микроорганизмов, в основном бактерий, вирусов и грибков. КМ играет центральную роль в поддержании здоровья человека, обеспечивая барьерную функцию кишечника, модуляцию иммунного ответа, синтез метаболитов, а также прямую защиту от инфекций. Дисбиоз, характеризующийся несбалансированной КМ, связан с такими состояниями, как воспалительные заболевания кишечника, злокачественные новообразования, сахарный диабет и ожирение [4]. Все больше данных указывает на существование взаимодействий между КМ и центральной нервной системой (ЦНС) [5] (рисунок 1)
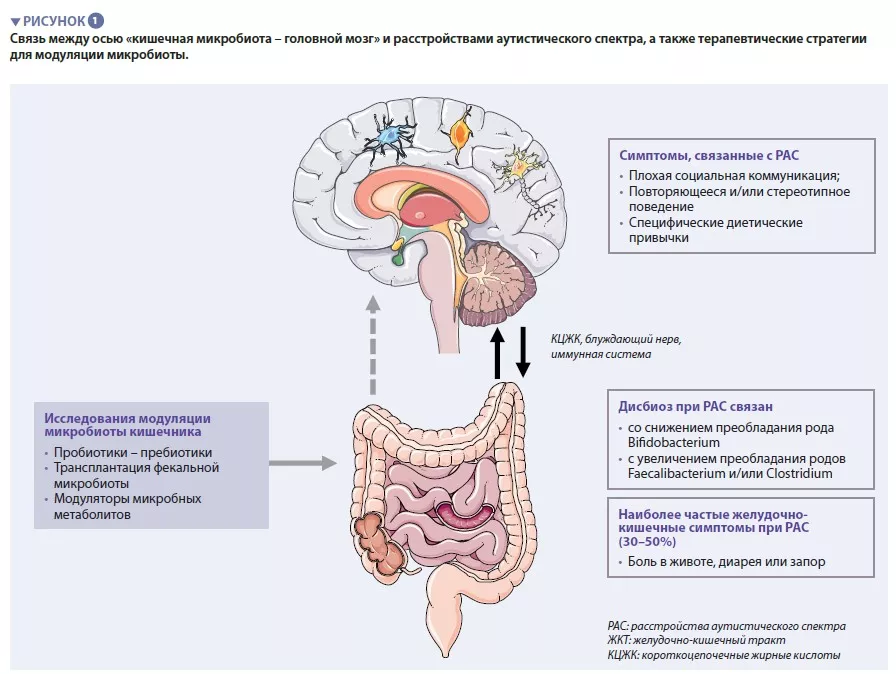
Перекрестная связь между головным мозгом и КМ опосредуется микробными метаболитами (в основном короткоцепочечными жирными кислотами) и иммуномодуляторами, которые непосредственно пересекают гематокишечный и гематоэнцефалический барьеры или стимулируют блуждающий нерв [6]. Показано, что КМ участвует в регулировании человеческого поведения и когнитивных навыков, в частности, социально-коммуникационных, хотя точные механизмы этого до сих пор не известны [5].
РАС — это патология нервно-психического развития, которая характеризуется нарушениями социального общения, социального взаимодействия и повторяющимся / стереотипным поведением. Заболевание проявляется в детском возрасте и затрагивает приблизительно 1% населения Земли. РАС в основном обусловлены генетическими факторами, при этом доля наследственности составляет 80–90%. Тем не менее, пре- и постнатальные влияния окружающей среды могут выступать в качестве провоцирующих факторов или модуляторов тяжести симптомов. Динамика развития головного мозга на ранних этапах жизни пересекается с динамикой развития КМ. Последняя начинает развиваться сразу после рождения и через 3 года созревает до почти взрослого состояния. Ранний состав КМ во многом зависит от факторов о к р у ж а ю щ е й с р е д ы , т а к и х к а к м е с т о рождения, способ родоразрешения, грудное вскармливание и ксенобиотики (например, применение антибиотиков).
Стерильные мыши являются моделью живых существ, не содержащих в себе микроорганизмов. Такие модели ценны для расшифровки механизмов, лежащих в основе влияния КМ на развитие нервной системы, а также оценки взаимосвязи между микробиомом и заболеванием. Исследования показали, что у таких мышей отмечается i) нарушение проницаемости г е м а т о э н ц е ф а л и ч е с к о г о б а р ь е р а , ii) увеличение объема головного мозга, iii) незрелость микроглии, iv) снижение иммунных реакций со стороны микроглии, v) повышение миелинизации и vi) снижение экспрессии мозгового нейротрофического ф а к т о р а и с у б ъ е д и н и ц N - м е т и л - D - а с п а р т а т н о г о р е ц е п т о р а [ 5 , 7 ] . В с е э т и д а н н ы е п о д ч е р к и в а ю т р о л ь К М в формировании и поддержании целостности гематоэнцефалического барьера, а также в нейрогенезе, гомеостазе микроглии, миелинизации и росте/функционировании головного мозга.
МИКРОБИОТА КИШЕЧНИКА, ЖЕЛУДОЧНО-КИШЕЧНЫЕ СИМПТОМЫ И РАССТРОЙСТВА АУТИСТИЧЕСКОГО СПЕКТРА
С т е р и л ь н ы е м ы ш и д е м о н с т р и р о в а л и а у т и с т и ч н о е п о в е д е н и е , к о т о р о е включало в себя социальное избегание, повторяющиеся / стереотипные действия, отсутствие интереса к изменяющимся социальным условиям. Некоторые из этих видов поведения исчезали после введения в кишечник стерильных мышей микробиоты мышей дикого типа, тогда как введение КМ от мышей с РАС усугубляло имеющиеся н а р у ш е н и я . К М , п о - в и д и м о м у , и м е е т решающее значение для программирования и р е а л и з а ц и и с о ц и а л ь н ы х н а в ы к о в и адаптивного поведения [8].
Все больше данных указывает на то, что у детей с РАС очень распространены симптомы со стороны желудочно-кишечного тракта. Боль в животе, запор, диарея отмечаются почти у 30–50% пациентов с РАС и серьезно влияют на качество жизни детей [1]. Тяжесть желудочно- кишечных симптомов коррелирует со степенью тяжести аутистических симптомов и наличием дисбиоза кишечника, хотя к о н к р е т н ы е м и к р о б н ы е с и г н а т у р ы , ассоциированные с симптомами аутизма, еще не определены. В исследованиях КМ сообщалось о различиях в разнообразии микробиоты и аномальных метаболических паттернах по сравнению со здоровыми людьми. В двух недавних метаанализах, посвященных оценке КМ у пациентов с РАС, сообщается о снижении содержания Bifidobacterium и увеличении Faecalibacterium и Clostridium у пациентов с РАС [9, 10] по сравнению с контрольными участниками. Результаты изучения метаболома фекалий также показали увеличение у людей с РАС содержания р-крезола, бактериального метаболита-производного тирозина. Все эти данные могут указывать на потенциальную связь между нарушениями КМ и симптомами со стороны ЖКТ у пациентов с РАС.
Важно отметить, что большинство исследований показывают разные результаты и имеют методологические ограничения. Главный недостаток этих исследований заключается в наличии вмешивающихся факторов. Так, исследования проводились в разных странах, что может означать существенные различия в образе жизни и диетических привычках людей. В недавнем исследовании в когорте из 247 пациентов с РАС не сообщается о прямой связи дисбиоза КМ с диагнозом РАС или симптомами аутизма. Наличие дисбиоза ассоциировалось с менее разнообразной диетой, что характерно для пациентов с РАС [8].
Расстройства аутистического спектра, желудочно-кишечные симптомы и микробиота кишечника
Почти 30–50% пациентов с РАС сообщили о боли в животе, диарее, запоре и других симптомах со стороны ЖКТ. Несмотря на отсутствие специфических микробных сигнатур, дисбиоз КМ у пациентов с РАС был подтвержден с помощью метаанализа [9, 10]. Связь между дисбиозом КМ и РАС все еще плохо изучена. Некоторые исследования предполагают прямую связь через ось «КМ – головной мозг» между аутистическими симптомами и симптомами со стороны ЖКТ. Результаты недавнего исследования показали, что дисбиоз КМ у пациентов с РАС в основном связан с ограниченным рационом, который часто получают пациенты с РАС [8].
МОДУЛЯЦИЯ КИШЕЧНОЙ МИКРОБИОТЫ ПРИ РАССТРОЙСТВАХ АУТИСТИЧЕСКОГО СПЕКТРА
Все больше исследователей изучают потенциальное влияние терапевтических стратегий на основе микробиоты для улучшения симптомов ЖКТ и основных симптомов у людей с РАС.
Был сделан вывод, что пробиотики, живые микроорганизмы, могут оказывать благоприятное воздействие на пациентов с РАС. Ряд доклинических исследований показал повышение социальных взаимодействий у мышей с РАС, получавших добавки с пробиотиками (Bacteroides fragilis, Lactobacillus reuteri). Улучшение социальной коммуникации было связано с повышенной экспрессией окситоцина в ЦНС. В недавних исследованиях сообщалось о положительном влиянии пробиотиков на состав КМ и желудочно-кишечные симптомы при РАС [11]. Однако, об улучшении основных аутистических симптомов говорили лишь отдельные исследователи. Между большинством клинических исследований пробиотиков у пациентов с аутизмом были различия в подходах к лечению (суточные дозы или общая продолжительность применения пробиотиков). Тем не менее, даже если результаты некоторых исследований показали эффективность пробиотиков с точки зрения профилактики желудочно-кишечных симптомов у пациентов с РАС, их необходимо воспроизвести в других исследованиях, чтобы достоверно подтвердить пользу рассматриваемого лечения.
У пациентов с РАС также изучали эффективность пребиотиков, таких как галактоолигосахариды (GOS) или фруктоолигосахариды [12]. У мышей с хроническим стрессом отмечалось изменение КМ и снижение социального интереса. Введение пребиотиков таким мышам вызывало у них усиление социальных взаимодействий. У человека применение GOS на фоне диеты без казеина и глютена показало улучшение социальных взаимодействий и симптомов со стороны ЖКТ, а также увеличение содержания Bifidobacterium в КМ. Для подтверждения полученных данных нужны соответствующие двойные слепые рандомизированные клинические исследования.
Также при РАС изучалась трансплантация фекальной микробиоты (ТФМ). ТФМ подразумевает перенос КМ от донора для модификации КМ реципиента. Ее эффективность в отношении инфекции, вызванной Clostridioides difficile, в настоящее время полностью доказана, в том числе у детей. В недавнем поисковом открытом нерандомизированном клиническом исследовании с участием 18 детей с диагнозом РАС и ЖК симптомами эффективность ТФМ оценивали по модифицированному протоколу [13]. Этот протокол предполагал двухнедельное лечение антибиотиками, очищение кишечника и собственно ТФМ, которая включала высокую начальную дозу, вводимую перорально или ректально, с последующей пероральной поддерживающей терапией в течение 7–8 недель. В начале лечения ванкомицином наблюдались нежелательные явления (нарушение поведения, гиперкинезия), которые исчезли спонтанно через 3 дня лечения. ТФМ приводила к значимому улучшению симптомов со стороны желудочно-кишечного тракта через 8 недель. Интересно, что у пациентов отмечалось улучшение основных аутистических симптомов (стереотипное и повторяющееся поведение, нарушения социального взаимодействия). Улучшение ЖК симптомов и симптомов аутизма сохранялось через 2 года после лечения и коррелировало с повышенным разнообразием КМ [14]. Через два года после ТФМ среднее снижение общего балла по шкале оценки желудочно-кишечных симптомов (GSRS) все еще превышало 50%. Изменения симптомов аутизма, измеренные с помощью шкалы оценки аутизма у детей (CARS), шкалы социальной реакции (SRS) или перечня симптомов аутистического поведения (ABC), положительно коррелировали с процентными изменениями в баллах GSRS. Тем не менее, эти результаты еще не подтверждены в плацебо-контролируемых двойных слепых рандомизированных исследованиях.
Недавно в открытом пилотном исследовании был изучен эффект перорального введения невсасывающегося в желудочно-кишечном тракте адсорбента (AB-2004), модулирующего содержание ряда метаболитов КМ. Авторы сообщили о снижении тревожно-подобного поведения у мышей на фоне снижения содержания микробных метаболитов в кишечнике [15]. Также были представлены предварительные результаты клинического исследования, в котором 30 подростков с РАС в течение 8 недель получали AB-2004 в дозе, скорректированной с учетом массы тела. На 8 неделе наблюдалось снижение уровня метаболитов КМ в плазме и моче. Важно отметить, что после лечения симптомы со стороны ЖКТ, аутистическое поведение, тревога и раздражительность наблюдались у меньшего количества пациентов. Остаточный эффект сохранялся через 4 недели после его завершения [15]. Факторы, обуславливающие клиническую эффективность AB-2004, еще предстоит определить. Также нуждаются в изучении некоторые косвенные факторы, такие как влияние AB-2004 на изменения питания, иммунный статус или функцию ЖКТ. Для более глубокого изучения влияния AB-2004 на социальное поведение людей нужны более масштабные двойные слепые плацебо-контролируемые исследования. Расстройства аутистического спектра, желудочно-кишечные симптомы и микробиота кишечника Почти 30–50% пациентов с РАС сообщили о боли в животе, диарее, запоре и других симптомах со стороны ЖКТ. Несмотря на отсутствие специфических микробных сигнатур, дисбиоз КМ у пациентов с РАС был подтвержден с помощью метаанализа [9, 10]. Связь между дисбиозом КМ и РАС все еще плохо изучена. Некоторые исследования предполагают прямую связь через ось «КМ – головной мозг» между аутистическими симптомами и симптомами со стороны ЖКТ. Результаты недавнего исследования показали, что дисбиоз КМ у пациентов с РАС в основном связан с ограниченным рационом, который часто получают пациенты с РАС [8].
Учитывая отсутствие специфических вариантов лечения желудочно-кишечных и аутистических симптомов у пациентов с РАС, следует более активно прибегать к новым хорошо переносимым методам, целенаправленно воздействующим на КМ или микробные метаболиты (например, ТФМ), особенно на ранних и критических стадиях развития головного мозга в детском возрасте.
Трансплантация фекальной микробиоты у пациентов с РАС
ТФМ или трансплантация фекальной микробиоты — это новый эффективный способ модуляции КМ, используемый при желудочно-кишечных и эндокринных заболеваниях. ТФМ может стать новым эффективным средством модуляции/перезагрузки КМ при РАС. На мышиных моделях РАС ТФМ эффективно улучшала основные симптомы аутизма, такие как нарушения социального взаимодействия и стереотипное поведение. Результаты открытого исследования с участием взрослых пациентов с РАС показали, что ТФМ может улучшить не только симптомы со стороны ЖКТ, но и симптомы РАС. Положительные эффекты лечения сохранялись в течение 2 лет после его завершения. Интересно, что эффективность была связана с повышением разнообразия КМ. ТФМ может стать новым передовым методом лечения желудочно-кишечных и поведенческих симптомов у детей с РАС и помочь раскрыть новые аспекты физиологии социального взаимодействия у человека.

ЗАКЛЮЧЕНИЕ
Влияние кишечной микробиоты на развитие нервной системы у детей в значительной степени не изучено. Исследований, посвященных изучению влияния модуляции микробиоты кишечника на раннее развитие ребенка, особенно в плане социального общения, не проводилось. Предварительные исследования у взрослых и детей показали, что модуляция КМ приводит к улучшению симптомов ЖКТ и аутистического поведения. На основании этих данных будет проведено двойное слепое клиническое исследование с участием детей с РАС на самых ранних этапах когнитивного развития (до 6 лет). Цель исследования — понять, приведет ли ТФМ, выполненная в этот критически важный период развития, к значимым долгосрочным улучшениям показателей развития ребенка.







