Novas perspetivas no autismo: o papel da microbiota na comunicação social
Síntese
Pelo Dr. Vincent Trebossen
Departamento de Psiquiatria da Criança e do Adolescente, Hospital Robert-Debré, APHP, Paris, França
Pelo Dr. Pierre Ellul
Departamento de Psiquiatria da Criança e do Adolescente, Hospital Robert-Debré, APHP, Imunologia - Imunopatologia - Imunoterapia, Hospital Pitié Salpêtrière, U959 Inserm, Paris, França
Pelo Dr. Alexis Mosca
Serviço de Gastroenterologia Pediátrica, Hospital Robert-Debré, APHP, Paris, França
Pelo Pr. Richard Delorme
Departamento de Psiquiatria da Criança e do Adolescente, Hospital Robert-Debré, APHP, Genética Humana e Funções Cognitivas, Institut Pasteur, UMR3571 CNRS, Universidade Paris-Cidade, Paris, França
Área para o público geral
Encontre aqui o seu espaço dedicado
en_sources_title
en_sources_text_start en_sources_text_end
Capítulos

Sobre este artigo
As Perturbações do Espectro do Autismo (ASD) são perturbações complexas do neurodesenvolvimento que afetam 1% da população em geral e que se caracterizam por um défice na comunicação social e comportamentos repetitivos/ estereotipados. Os mecanismos fisiopatológicos por detrás das ASD são ainda mal compreendidos [1]. Trinta a 50% dos indivíduos com ASD apresentam sintomas gastrointestinais (GI), como dor abdominal, diarreia, obstipação, que afetam a sua qualidade de vida e o seu funcionamento global. Curiosamente, a ocorrência e a gravidade dos sintomas GI estão fortemente correlacionados com sintomas de autismo [2]. Enquanto que a etiologia dos sintomas GI é ainda desconhecida, vários estudos sugeriram que as ASD poderão resultar de um desequilíbrio na composição da microbiota intestinal (GM) [3]. Achados consistentes sugerem interações robustas entre a GM e o sistema nervoso central (SNC). A GM afeta diretamente o neurodesenvolvimento através do impacto da neurogénese, sobrevivência dos neurónios, crescimento do cérebro e mielinização. A modulação da GM utilizando pro- ou prebióticos ou transplante de microbiota fecal (FMT) em indivíduos com ASD mostra efeitos benéficos e a longo prazo nos sintomas GI e n os sintomas centrais do autismo. No entanto, são necessários ensaios aleatorizados maiores em dupla ocultação para confirmar a eficácia das terapias de base microbiana nas ASD, especificamente numa fase precoce e crítica do neurodesenvolvimento.
MICROBIOTA INTESTINAL, SISTEMA NERVOSO CENTRAL E NEURODESENVOLVIMENTO
A microbiota intestinal (GM) humana é constituída por aproximadamente 1013 microrganismos, principalmente bactérias, fungos e vírus. A GM desempenha um papel central na saúde humana, assegurando a função de barreira intestinal, modulação da resposta imunitária e síntese metabólica, mas também uma proteção direta contra infeções. A disbiose caracterizada por uma GM desequilibrada tem sido associada a várias doenças, como doenças inflamatórias intestinais, cancros, diabetes ou obesidade [4]. Achados consistentes também sugerem interações robustas entre a GM e o sistema nervoso central (SNC) [5] (Figura 1).
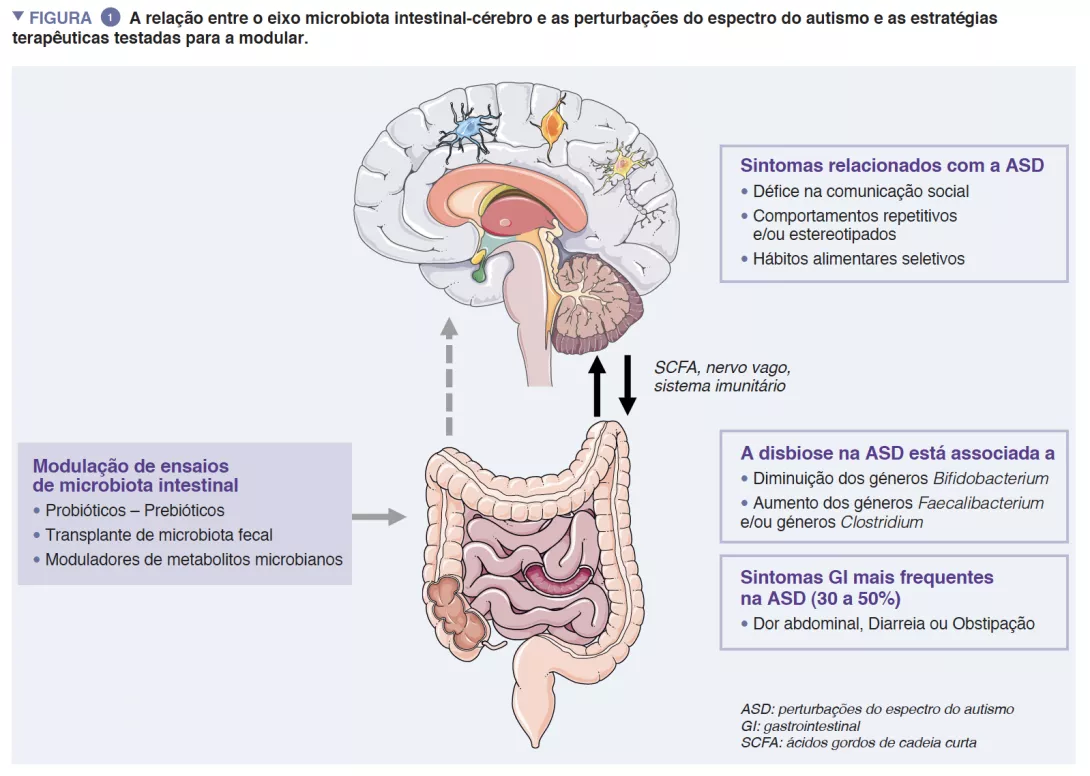
Um cruzamento recíproco entre o cérebro e a GM é mediado por metabolitos microbianos (principalmente ácidos gordos de cadeia curta) e moduladores imunitários diretamente, atravessando tanto as barreiras intestinal e cerebral como indiretamente através da estimulação do nervo vago [6]. As provas apoiam o envolvimento da GM na regulação tanto dos comportamentos humanos como dos cognitivos - especificamente das competências de comunicação social – mesmo que os seus mecanismos exatos sejam ainda desconhecidos [5].
As ASD são perturbações do neurodesenvolvimento caracterizadas por deficiências na comunicação social, interações sociais e comportamentos repetitivos/estereotipados, de início na infância que afetam cerca de 1% da população em geral. O determinismo das ASD é principalmente impulsionado por fatores genéticos, com uma heritabilidade estimada em 0,8 0,9, mas os eventos ambientais pré e pós-natais podem funcionar como fatores precipitantes ou moduladores da gravidade dos sintomas. A trajetória do desenvolvimento do cérebro numa fase precoce da vida sobrepõe-se às da GM. Esta última começa a desenvolver-se cedo após o nascimento e a sua composição estabiliza-se num perfil semelhante ao de um adulto por volta dos 3 anos de idade. A composição precoce da GM é profundamente influenciada por fatores ambientais, como o local de nascimento, modo de parto, amamentação e xenobióticos (por exemplo, utilização de antibióticos).
Os ratinhos sem germes são um modelo sem todos os microrganismos, por exemplo, são microbiologicamente axénicos (nenhum organismo vivo pode ser cultivado a partir de espécimes de ratinhos sem germes). Os modelos de ratinhos sem germes são valiosos para decifrar os mecanismos subjacentes aos papéis da GM no neurodesenvolvimento, mas também a relação entre o microbioma e a doença. Estudos demonstraram que os ratinhos sem germes apresentam i) defeito na permeabilidade da barreira cérebro-sangue; ii) maior volume cerebral; iii) expressão mais imatura do gene da microglia e menor resposta imunitária microglial; iv) aumento da mielinização; e v) diminuição da expressão do fator neurotrófico derivado do cérebro e numa subunidade de recetores de N-Metil-D-Aspartato [5, 7]. Todos estes dados salientam o papel da GM na formação e integridade da barreira hemato- encefálica, neurogénese, homeostase da microglia, mielinização e crescimento/ função cerebral.
Microbiota intestinal, sintomas gastrointestinais e perturbações do espectro do autismo
Os ratinhos sem germes apresentaram comportamentos do tipo autista, como evasão social, comportamentos repetitivos/ estereotipados, falta de interesse pela novidade social. Alguns destes comportamentos desapareceram após a colonização por uma GM a partir de ratinhos do tipo selvagem, enquanto que a colonização pela GM a partir de modelos de ratinhos ASD aumentou estes comportamentos. A GM parece, de facto, crucial para a programação e apresentação de competências sociais e comportamentos adaptativos [8]. Um número crescente de provas mostra que os sintomas GI estão sobre-representados nas crianças com ASD. Sintomas GI, como dor abdominal, obstipação, diarreia, são reportados em quase 30-50% dos doentes com ASD e têm um impacto profundo na qualidade de vida das crianças [1]. A gravidade dos sintomas GI foi correlacionada com a gravidade dos sintomas autísticos e a disbiose intestinal está bem documentada, mesmo que ainda não exista uma assinatura específica relacionada com sintomas autísticos. Estudos que exploram a GM reportaram diferenças na diversidade da microbiota e padrões anormais de metabolitos, quando comparados com controlos saudáveis. Duas meta-análises recentes que exploram a composição da GM em doentes com ASD reportaram uma diminuição em Bifidobacterium e um aumento dos géneros Faecalibacterium e Clostridium em doentes com ASD [9, 10] em comparação com os controlos. A exploração do metaboloma fecal também mostrou um aumento do p-cresol, um metabolito bacteriano derivado da tirosina, em indivíduos com ASD. Todos juntos, estes dados podem indicar a potencial associação entre anomalias da GM e sintomas GI em doentes com ASD.
No entanto, a maioria dos estudos tem resultados heterogéneos e limitações metodológicas. Fatores meramente confundidores, como diferentes países com diferentes estilos de vida e hábitos alimentares, são os principais inconvenientes destes estudos. De facto, um estudo recente numa grande coorte de 247 indivíduos com ASD não reportou ligações diretas entre o diagnóstico de ASD ou sintomas de autismo e a disbiose da GM. A disbiose foi associada a uma dieta menos diversificada que é comum em doentes com ASD [8].
Perturbações do espectro do autismo (ASD), sintomas gastrointestinais (GI) e microbiota intestinal (GM)
Praticamente 30 a 50% dos doentes com ASD reportaram sintomas GI, como dor abdominal, diarreia, obstipação. A disbiose da GM em doentes com ASD foi bem explorada e confirmada através de metaanálise, mesmo que não haja uma assinatura específica do microbioma [9, 10]. A ligação entre a disbiose da GM e as ASD ainda é mal compreendida. Alguns estudos sugerem ligações diretas através do eixo GM-cérebro que influenciam sintomas autísticos e sintomas gastrointestinais. Mais recentemente, um estudo sugere que a disbiose da GM em doentes com ASD está principalmente ligada à dieta restritiva que é frequente em doentes com ASD [8].
Modulação da microbiota intestinal nas perturbações do espectro do autismo
Um número crescente de estudos explorou o impacto potencial das estratégias terapêuticas baseadas na microbiota para melhorar os sintomas GI e os principais sintomas em indivíduos com ASD.
Os probióticos, microrganismos vivos, têm sido utilizados nas ASD e podem ter um efeito benéfico nos doentes com ASD. Alguns estudos pré-clínicos mostraram um aumento das interações sociais com a suplementação de probióticos (Bacteroides fragilis NCTC9343, Lactobacillus reuteri MM4-1A) em modelos de ratinhos com ASD. A melhoria da comunicação social foi ligada a uma expressão aumentada de oxitocina no SNC. Nos humanos, vários estudos reportaram efeitos positivos dos tratamentos probióticos na composição de GM e sintomas GI nas ASD [11]. No entanto, poucos deles reportaram uma melhoria dos sintomas principais de autismo. A maioria dos ensaios clínicos que forneceram probióticos em indivíduos autistas mostrou inconsistência em termos de probióticos, administração de dosagem por dia ou no total e duração de todo o tratamento. Mesmo que alguns estudos sugiram que os probióticos poderão ser interessantes para prevenir sintomas GI em doentes com ASD, os resultados exigem a replicação para garantir o efeito positivo de tal estratégia.
Do mesmo modo, a eficácia dos prebióticos, como o galacto-oligossacarídeo (GOS) ou o fructo oligossacarídeo, foi explorada nas ASD [12]. Ratinhos com stress crónico mostraram alterações na GM e uma diminuição do interesse social. Utilizando este modelo de ratinho, a administração de prebióticos foi associada a um aumento das interações sociais nestes ratinhos. Nos humanos, a utilização de GOS associados a uma dieta sem caseína e sem glúten mostrou uma melhoria nos sintomas GI e nas interações sociais, juntamente com um aumento da abundância de Bifidobacterium da GM. São necessários estudos clínicos aleatorizados em dupla ocultação adequados para confirmar as provas preliminares.
O transplante de microbiota fecal (FMT) também tem sido estudado nas ASD. O FMT envolve o transplante de GM de um doador para modificar a GM do recetor. A sua eficácia na infeção por Clostridioides difficile está agora bem demonstrada, mesmo em crianças. Um recente ensaio clínico exploratório sem ocultação e não aleatorizado que envolveu 18 crianças diagnosticadas com ASD e GI avaliou o efeito da terapia de transferência de microbiota (MTT) - um protocolo modificado do FMT [13]. A MTT consistiu num tratamento antibiótico de duas semanas, uma limpeza intestinal, antes de receber o tratamento MTT que consistiu numa dose elevada através de administração oral ou retal seguida de uma dose de manutenção oral durante 7 a 8 semanas. Foram observados eventos adversos no início do tratamento com vancomicina (comportamentos perturbadores, hipercinesia) mas desapareceram espontaneamente após 3 dias de tratamento. O protocolo MTT levou a uma melhoria significativa dos sintomas GI após o seguinte inquérito às 8 semanas. Mais surpreendentemente, também tinha sido observada uma melhoria dos sintomas principais do autismo (comportamentos estereotipados e repetitivos, competências de comunicação social) 8 semanas após a MTT. Curiosamente, a melhoria dos sintomas GI e sintomas de autismo persistiu 2 anos após o tratamento e foi correlacionada com o aumento da diversidade da GM [14]. Dois anos após a MTT, a redução média da Escala de Classificação dos Sintomas Gastrointestinais (GSRS) era ainda superior a 50%. As alterações nos sintomas autísticos medidas com a Escala de Avaliação do Autismo Infantil - CARS, a Escala de Responsabilidade Social - SRS, ou a Lista de Verificação do Comportamento Autista - ABC foram todas positivamente correlacionadas com as alterações percentuais na pontuação GSRS. Estes resultados ainda não são confirmados por estudos aleatorizados em dupla ocultação controlados por placebo.
Recentemente, um ensaio clínico piloto sem ocultação em ASD explorou o efeito de um adsorvente oral restrito a GI (AB- 2004) modulando vários metabolitos GM. Os autores reportaram uma diminuição dos comportamentos de ansiedade em ratinhos, impulsionada por uma diminuição do metabolito microbiano intestinal [15]. O estudo também apresentou resultados preliminares de um ensaio clínico em que uma dose do AB-2004 ajustada ao peso foi administrada, durante 8 semanas, a 30 adolescentes com ASD. Na semana 8, foram observados níveis reduzidos de metabolitos GM no plasma e na urina. Mais interessante, após o tratamento, menos sujeitos apresentaram sintomas GI mas também comportamentos associados às ASD, ansiedade, e irritabilidade. Houve também um efeito remanescente com uma persistência da eficácia às 4 semanas após a interrupção do tratamento [15]. Os fatores que ligam as melhorias clínicas e a administração do AB-2004 continuam por determinar, alguns fatores indiretos não foram estudados, como o efeito do AB-2004 nas mudanças nutricionais, no estado imunitário ou na função gastrointestinal. Estudos maiores e em dupla ocultação controlados por placebo são justificados para dissecar ainda mais o papel do AB-2004 na comunicação social no ser humano.
No contexto da falta de tratamento específico para os sintomas GI e sintomas autísticos em doentes com ASD, novas estratégias terapêuticas bem toleradas que visem metabolitos GM ou microbianos, como FMT/MTT, precisam de ser mais especificamente realizadas nas fases iniciais e críticas do desenvolvimento cerebral durante a infância.
Transplante de Microbiota Fecal (FMT) em doentes com ASD
O FMT é uma nova forma eficiente de modular a GM utilizada em doenças gastrointestinais e endócrinas. O transplante de microbiota fecal (FMT) poderá representar uma nova e eficiente oportunidade de modular/reinicializar a GM nas ASD. Utilizando modelos de ratinho de ASD, o FMT melhorou eficazmente os sintomas centrais do autismo, como défices de comunicação social e comportamentos estereotipados. Nos humanos, um ensaio piloto sem ocultação em adultos com ASD sugeriu que o FMT poderá melhorar não só os sintomas GI mas também a reciprocidade social e os comportamentos estereotipados. Ocorreu um efeito remanescente com uma eficácia persistente 2 anos após a interrupção do tratamento. Curiosamente, a eficácia foi associada a uma maior diversidade da GM. O FMT poderá ser uma nova estratégia terapêutica de vanguarda para tratar os sintomas gastrointestinais e comportamentais em crianças com ASD, e apenas abrir novos caminhos para a fisiologia da comunicação social no ser humano.

Conclusão
O impacto da microbiota intestinal na trajetória de neurodesenvolvimento das crianças permanece em grande parte inexplorado. Neste momento, não existem estudos que explorem o impacto da modulação da microbiota intestinal na fase inicial do desenvolvimento infantil, particularmente nas competências de comunicação social. Estudos preliminares em adultos e crianças demonstraram que a modulação da GM leva a uma melhoria dos sintomas GI e dos comportamentos autísticos. Com base nestes dados, iremos realizar um ensaio clínico em dupla ocultação em crianças mais novas com ASD numa fase muito precoce do seu desenvolvimento cognitivo (antes dos 6 anos de idade). O nosso objetivo é compreender se o FMT realizada num período crítico de desenvolvimento resultará numa melhoria significativa a longo prazo da trajetória de desenvolvimento infantil.





