Diarreia e o papel da microbiota
Pela Dra. Sanda Maria Cretoiu
Departamento de Ciências Morfológicas, Biologia Celular e Molecular e Histologia, Universidade de Medicina e Farmácia “Carol Davila” de Bucareste, Roménia
Área para o público geral
Encontre aqui o seu espaço dedicado
en_sources_title
en_sources_text_start en_sources_text_end
Capítulos

Sobre este artigo
Os distúrbios intestinais podem manifestar sintomas como fezes frequentes e soltas, conhecidas como diarreia. Este sinal do sistema digestivo pode ocorrer por diversas razões, desde infeções e reações a determinados alimentos até reações adversas a medicamentos e condições de saúde pré-existentes - resumidas em [1]. A microbiota intestinal, ou seja, a totalidade dos microrganismos presentes no intestino, é essencial para a preservação da saúde digestiva e pelo seu impacto no funcionamento do intestino. Estudos recentes ilustram a relação entre a microbiota e a diarreia de etiologia diversa. Uma microbiota equilibrado e diversificado é vital para a saúde digestiva global, a absorção de nutrientes e a regulação do sistema imunitário. Atualmente, existe uma tendência para a introdução em larga escala de formas de reprogramar a comunidade microbiana intestinal: pré-bióticos, probióticos e pós-bióticos ou o transplante de matéria fecal para prevenir ou tratar a diarreia. A investigação sobre a modulação da microbiota oferecerá, num futuro próximo, estratégias acionáveis para a prevenção e o tratamento da diarreia. A visão geral que se segue abrange as principais doenças diarreicas relacionadas com a disbiose e alguns aspetos relativos à gestão da microbiota para melhorar estas afeções gastrointestinais.
A relação entre a microbiota e a diarreia
A diarreia pode envolver vários mecanismos (tabela 1), e a maioria deles está relacionada com o papel da microbiota:
- • A proteção do equilíbrio microbiano. Este estado, conhecido como eubiose, é fundamental para a saúde do corpo humano, pois impede e retarda a expansão dos agentes patogénicos. A perturbação do equilíbrio entre as principais estirpes microbianas, conhecida como disbiose, pode aumentar a suscetibilidade a infeções e contribuir para a diarreia. A literatura geralmente indica que a diarreia representa uma disbiose importante e que o grau de disbiose está relacionado com a etiologia e a fase da diarreia [6]. Após a diarreia aguda, a taxonomia da microbiota muda muito. Nas fases iniciais da diarreia, os anaeróbios facultativos de crescimento rápido, como as Proteobactérias (principalmente Enterobacteriaceae/Escherichia coli) e os Streptococcus (principalmente Streptococcus salivarius e Streptococcus gallolyticus) dominam e favorecem o desaparecimento drástico dos anaeróbios obrigatórios comensais do intestino (Blautia, Prevotella, Faecalibacterium, Lachnospiraceae, Ruminococcaceae, etc.) [2, 3]. A consequência é que os ácidos gordos de cadeia curta (AGCC) também diminuem e a integridade da barreira intestinal começa a estar ameaçada, levando possivelmente à permeabilidade intestinal. Na fase de recuperação após a diarreia, um modelo proposto mostra que, na fase intermédia, existe uma abundância de Bacteroides (o 7.º dia desde o início da doença). Ao mesmo tempo, na fase tardia, predominam Prevotella e Firmicutes produtoras de SCFA [4, 5].
- Proteção contra invasores patogénicos. A comunidade microbiana da microbiota intestinal compete por recursos, produz substâncias antimicrobianas e atua como uma barreira contra os enteropatógenos. Foi demonstrado que as bactérias benéficas do intestino, como certas estirpes de Bifidobacteria e Lactobacilli, têm efeitos benéficos na diarreia infeciosa causada por rotavírus em crianças pequenas. No entanto, não existem ensaios clínicos que o demonstrem [6].
- Regulação do sistema imunitário. A microbiota intestinal ajuda a educar e a modular as respostas imunitárias, promovendo a tolerância a substâncias inofensivas e a defesa contra agentes patogénicos. A desregulação da resposta imunitária devido a desequilíbrios da microbiota pode contribuir para a inflamação e a diarreia. Após a administração de antibióticos para a diarreia induzida por Clostridioides difficile, como a vancomicina, observa-se uma abundância relativa reduzida de Bacteroidetes e Firmicutes, enquanto as Proteobacteria e Fusobacteria aumentam e conduzem a uma diminuição do propionato de SCFA, criando premissas para a inflamação [7].
- Manutenção da função intestinal e do metabolismo. As bactérias benéficas fermentam as fibras alimentares para produzir ácidos gordos de cadeia curta (AGCC), como o acetato, o propionato e o butirato. Os AGCC contribuem para a manutenção de um revestimento intestinal saudável, promovem a absorção de água e fornecem uma fonte de energia para os colonócitos. Os desequilíbrios entre as estirpes bacterianas podem afetar estas funções, levando a diarreia funcional devido à diminuição da produção de AGCC. O aumento da sua produção melhora a absorção dos fluidos do cólon. [8].

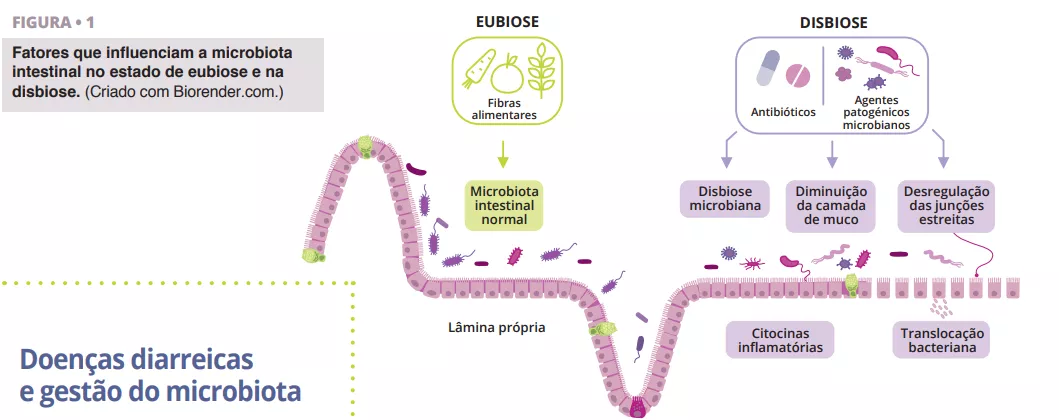
Doenças diarreicas e gestão do microbiota
Diarreia infeciosa
As infeções intestinais bacterianas, virais ou parasitárias causam diarreia aguda e são frequentemente transmitidas através de água contaminada. A maioria dos casos de diarreia melhora em poucos dias, mas a diarreia grave pode levar a uma desidratação séria e pode tornar-se letal [9].
O rotavírus continua a ser a principal causa de mortes associadas à diarreia em crianças [11], e a gestão desta doença viral envolve geralmente hidratação oral ou intravenosa, adaptada à gravidade da desidratação [12]. Além disso, com base nas conclusões mais recentes do comité ESPGHAN (2023) [13], os prestadores de cuidados de saúde podem sugerir determinadas estirpes probióticas para episódios gastroentéricos agudos em crianças, reconhecendo o seu potencial (certeza da evidência: baixa; grau de recomendação: fraco) para diminuir a duração da diarreia, e/ou o tempo de internamento hospitalar, e/ou o volume de descarga fecal. No entanto, um ensaio aleatório, em dupla ocultação, controlado em crianças bolivianas com diarreia aguda por rotavírus demonstrou uma diminuição da duração da diarreia utilizando uma solução de reidratação oral mais uma mistura de probióticos em comparação com uma solução de reidratação simples [11].
Diarreia do viajante
Mais de 60% dos adultos de países desenvolvidos que viajam para países em desenvolvimento sofrem de diarreia aguda, também conhecida como diarreia do viajante (DT). Os agentes patogénicos mais frequentemente identificados e implicados nos episódios de diarreia do viajante são Escherichia coli, Campylobacter jejuni, espécies de Salmonella e espécies de Shigella. Assim, as estratégias de tratamento recomendadas incluem a terapia antibiótica com azitromicina ou fluoroquinolonas para casos moderados a graves [14]. Contudo, os antibióticos não são recomendados para prevenir a DT, devido à insuficiência de provas da sua eficácia profilática e, em parte, devido ao risco de resistência aos antibióticos [15].
Existem dados contraditórios relativamente à eficácia dos probióticos na prevenção da diarreia do viajante [16]. Uma revisão sistemática e meta-análise comparou a eficácia da rifaximina e dos probióticos na prevenção da DT [14].
Diarreia associada a antibióticos
Os antibióticos são um dos medicamentos mais prescritos e representam um tratamento eficaz para várias patologias infeciosas [17]. Uma das complicações associadas à terapêutica antibiótica é a diarreia associada a antibióticos (DAA), que ocorre em 5%-35% dos doentes que recebem antibioterapia [18]. A DAA pode ser definida como três ou mais fezes líquidas ou soltas por dia, durante pelo menos dois dias consecutivos, que está estritamente relacionada com a administração de antibióticos e nenhuma outra causa [14]. O maior risco é atribuído às aminopenicilinas, cefalosporinas e clindamicina, que têm como alvo principal os anaeróbios [19].
A ausência de um agente infecioso identificado na DAA pode ser explicada pelo efeito tóxico direto dos antibióticos na mucosa intestinal, que pode causar diarreia. Devido às suas propriedades benéficas, os probióticos estão agora a ser investigados e utilizados tanto para o tratamento como para a profilaxia da DAA [16, 18].
Diarreia associada a Clostridioides difficile
A infeção por Clostridioides difficile (CD) é a causa mais comum de diarreia nosocomial associada a antibióticos em adultos. Os fatores de risco incluem idade superior a 65 anos, hospitalização prolongada em cuidados intensivos e administração de antibióticos (fluoroquinolonas, clindamicina, cefalosporinas e betalactâmicos, em particular) ou inibidores da bomba de protões.
Durante a antibioterapia, os anaeróbios que produzem AGCC podem desaparecer devido a alterações induzidas pelos antibióticos na microbiota intestinal, que podem também perturbar o metabolismo dos hidratos de carbono e da bílis e causar um desequilíbrio osmótico. Após a ingestão de antibióticos, são afetadas as três barreiras intestinais: as células epiteliais intestinais, a camada de muco e péptidos antimicrobianos e a camada imunoprotetora composta por diferentes células imunitárias e várias biomoléculas (figura 1). Esse evento pode interferir na produção de mucina, citocinas e peptídeos antimicrobianos, desregulando a função intestinal e levando a outras infeções ou mesmo causando episódios recorrentes de infeções. A Associação Americana de Gastroenterologia (AGA) recomenda condicionalmente probióticos específicos para a prevenção da infeção por DC em indivíduos que tomam antibióticos, observando que a qualidade da evidência é baixa [20].
Descobertas emergentes e o futuro da gestão da diarreia
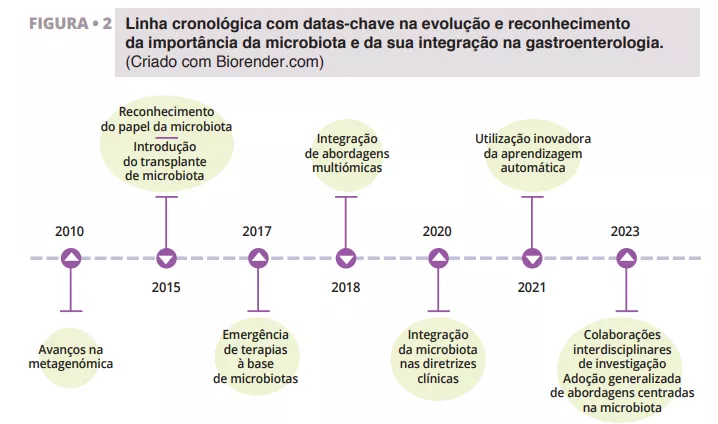
Os recentes avanços na investigação da microbiota, incluindo a análise metagenómica e o transplante microbiano, estão a revolucionar a nossa abordagem ao tratamento da diarreia (figura 2).
As opções de tratamento para a diarreia devem ter em conta os mecanismos causais envolvidos na génese da diarreia, desde toxinas infeciosas capazes de perturbar o equilíbrio de fluidos e eletrólitos a doentes que desenvolveram disbiose devido a outras causas e doentes com grandes quantidades de hidratos de carbono não absorvidos no lúmen que desencadeiam diarreia osmótica.
Existem poucos dados sobre os pré-bióticos e as fibras no tratamento da diarreia (tabela 2). Aparentemente, os pré-bióticos são mais propensos a prevenir e tratar a recorrência da diarreia. Ao mesmo tempo, as fibras, principalmente as viscosas, são mais indicadas nos episódios agudos devido à sua capacidade de retenção de água. Outras opções terapêuticas envolvem, em alguns casos, a administração de probióticos e (tabela 3), em casos graves, o uso de transplante de microbiota fecal (FMT).
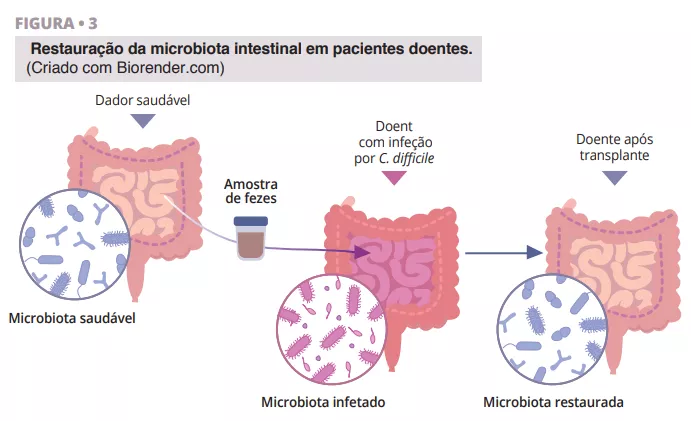
O fascinante percurso da descoberta da FMT tem raízes na China antiga, onde Ge Hong tratava doentes com diarreia grave utilizando uma “sopa amarela” constituída por uma suspensão de fezes. Nos tempos modernos, o Dr. Ben Eiseman utilizou enemas fecais de indivíduos saudáveis para tratar a enterocolite pseudomembranosa em 1958. Atualmente, existe um interesse crescente no transplante de microbiota fecal (FMT) como tratamento para a infeção recorrente por Clostridioides difficile (CDI), o que aponta para a sua utilidade [22]. Estão em curso investigações sobre a sua eficácia na doença inflamatória intestinal, diabetes, cancro, cirrose hepática e doenças cerebrais como a doença de Parkinson [23]. Os benefícios da utilização da FMT em doentes com diarreia baseiam-se na ideia de que a flora microbiana saudável introduzida através da FMT tem a capacidade de superar os agentes patogénicos e restaurar a composição de um microbioma intestinal saudável (figura 3).


Conclusão
A investigação revela que uma diversidade reduzida da microbiota intestinal está associada a uma maior suscetibilidade à diarreia, abrindo caminho a potenciais intervenções diagnósticas e terapêuticas. A manutenção de uma microbiota intestinal equilibrado e diversificado previne a diarreia e promove a saúde digestiva geral. Os desequilíbrios na microbiota, conhecidos como disbiose, podem resultar de diarreia aguda infeciosa ou de disbiose devida a outros fatores (uso frequente de antibióticos, dieta pouco saudável, má absorção) que podem contribuir para a diarreia crónica. A compreensão da complexa interação entre a composição microbiana e os sintomas clínicos é crucial para o tratamento personalizado da diarreia. Abordagens personalizadas baseadas em perfis de microbiota únicos podem conduzir a estratégias ou intervenções mais eficazes. A introdução de probióticos e de uma dieta rica em pré-bióticos, o transplante de microbiota, a integração de abordagens multiómicas, a utilização inovadora da aprendizagem automática e a tendência crescente de colaborações de investigação interdisciplinares podem ajudar a restabelecer o equilíbrio microbiano e a apoiar o bem-estar gastrointestinal. Espera-se que, no futuro, se possam conceber terapias baseadas no microbioma, como sugerido por Peter J. Turnbaugh, lançando a base para novos princípios de tratamento [25].
1. Iancu MA, Profir M, Roşu OA, et al. Revisiting the Intestinal Microbiome and Its Role in Diarrhea and Constipation. Microorganisms 2023; 11: 2177.
2. David L, Weil A, Ryan ET, et al. Gut microbial succession follows acute secretory diarrhea in humans. mBio 2015; 6: 1-14.
3. Sohail MU, Al Khatib HA, Al Thani AA, et al. Microbiome profiling of rotavirus infected children suffering from acute gastroenteritis. Gut Pathog 2021; 13: 21.
4. Becker-Dreps S, Allali I, Monteagudo A, et al. Gut Microbiome Composition in Young Nicaraguan Children During Diarrhea Episodes and Recovery. Am J Trop Med Hyg 2015; 93: 1187-93.
5. Cannon JL, Seabolt MH, Xu R, et al. Gut Microbiome Changes Occurring with Norovirus Infection and Recovery in Infants Enrolled in a Longitudinal Birth Cohort in Leon, Nicaragua. Viruses 2022; 14: 1395.
6. Azagra-Boronat I, Massot-Cladera M, Knipping K, et al. Strain-Specific Probiotic Properties of Bifidobacteria and Lactobacilli for the Prevention of Diarrhea Caused by Rotavirus in a Preclinical Model. Nutrients 2020; 12: 498.
7. Kim AH, Lee Y, Kim E, et al. Assessment of oral vancomycin-induced alterations in gut bacterial microbiota and metabolome of healthy men. Front Cell Infect Microbiol 2021; 11: 629438.
8. Binder HJ. Role of colonic short-chain fatty acid transport in diarrhea. Annu Rev Physiol 2010; 72: 297-313.
9. Collinson S, Deans A, Padua-Zamora A, et al. Probiotics for treating acute infectious diarrhoea. Cochrane Database Syst Rev 2020; 12:CD003048.
10. Desselberger U. Viral gastroenteritis. Medicine 2017; 45: 690-4.
11. GBD 2016 Diarrheal Disease Collaborators. Estimates of the global, regional, and national morbidity, mortality, and aetiologies of diarrhea in 195 countries: a systematic analysis for the Global Burden of Disease Study 2016. Lancet Infect Dis 2018; 18: 1211-8.
12. Iturriza-Gómara M, Cunliffe NA. 34 - Viral Gastroenteritis. Ryan ET, Hill DR, Solomon T, Aronson NE, Endy TP. (eds) Hunter’s Tropical Medicine and Emerging Infectious Diseases (tenth edition). Elsevier, 2020, pp. 289-307.
13. Szajewska H, Berni Canani R, Domellöf M et al.; ESPGHAN Special Interest Group on Gut Microbiota and Modifications. Probiotics for the Management of Pediatric Gastrointestinal Disorders: Position Paper of the ESPGHAN Special Interest Group on Gut Microbiota and Modifications. J Pediatr Gastroenterol Nutr 2023; 76: 232-47.
14. Kopacz K, Phadtare S. Probiotics for the Prevention of antibiotic-associated diarrhea. Healthcare 2022; 10: 1450.
15. Fan H, Gao L, Yin Z, et al. Probiotics and rifaximin for the prevention of travelers’ diarrhea: A systematic review and network meta-analysis. Medicine 2022; 101: e30921.
16. Girardin M, Seidman EG. Indications for the use of probiotics in gastrointestinal diseases. Dig Dis 2011; 29: 574-87.
17. Goodman C, Keating G, Georgousopoulou E, et al. Probiotics for the prevention of antibiotic-associated diarrhoea: a systematic review and meta-analysis. BMJ Open 2021; 11: e043054.
18. McFarland LV. Antibiotic-associated diarrhea: epidemiology, trends and treatment. Future Microbiol 2008; 3: 563-78.
19. Barbut F, Meynard JL. Managing antibiotic associated diarrhoea. BMJ 2002; 324: 1345-6.
20. Su GL, Ko CW, Bercik P, et al. AGA Clinical Practice Guidelines on the Role of Probiotics in the Management of Gastrointestinal Disorders. Gastroenterology 2020; 159: 697-705.
21. Codex AC. Report of the 31th session of the codex committee on nutrition and foods for special dietary uses. Rome, Italy: FAO/WHO 2009.
22. Peery AF, Kelly CR, Kao D, et al.; AGA Clinical Guidelines Committee. AGA Clinical Practice Guideline on Fecal Microbiota-Based Therapies for Select Gastrointestinal Diseases. Gastroenterology 2024; 166: 409-34.
23. Tariq R, Disbrow MB, Dibaise JK, etal. Efficacy of Fecal Microbiota Transplantation for Recurrent C. Difficile Infection in Inflammatory Bowel Disease. Inflamm Bowel Dis 2020; 26: 1415-20.
24. Guarino A, Ashkenazi S, Gendrel D, et al. European Society for Pediatric Gastroenterology, Hepatology, and Nutrition/European Society for Pediatric Infectious Diseases evidence-based guidelines for the management of acute gastroenteritis in children in Europe: update 2014. J Pediatr Gastroenterol Nutr 2014; 59: 132-52.
25. Rock RR, Turnbaugh PJ. Forging the microbiome to help us live long and prosper. PLoS Biol 2023; 21: e3002087.

