Diarrea y la función de la microbiota
Por la Dra. Sanda Maria Cretoiu
Departamento de Ciencias Morfológicas, Biología Celular y Molecular e Histología, Universidad de Medicina y Farmacia “Carol Davila” de Bucarest, Rumanía
Espacio para el público general
Encuentra aquí tu espacio dedicado
en_sources_title
en_sources_text_start en_sources_text_end
Capítulos

Acerca de este artículo
Los trastornos intestinales pueden presentar síntomas como heces frecuentes y líquidas, lo que se conoce como diarrea. Esta señal del aparato digestivo puede producirse por distintas razones, desde infecciones y reacciones a ciertos alimentos hasta reacciones adversas a medicamentos y enfermedades preexistentes (resumidas en [1]). La microbiota intestinal, es decir, el conjunto de microorganismos presentes en el intestino, es fundamental para preservar la salud digestiva y por su repercusión en el funcionamiento del intestino. Estudios recientes han ilustrado la relación entre la microbiota y la diarrea por causas diversas. Una microbiota equilibrada y diversa es fundamental para la salud digestiva general, la absorción de nutrientes y la regulación del sistema inmunitario. En la actualidad, hay una tendencia hacia la introducción a gran escala de formas de reprogramar la comunidad microbiana intestinal: prebióticos, probióticos y posbióticos o el trasplante de materia fecal para prevenir o tratar la diarrea. En un futuro próximo, la investigación sobre la modulación de la microbiota ofrecerá estrategias aplicables para la prevención y el tratamiento de la diarrea. A continuación, se repasan las principales enfermedades diarreicas relacionadas con la disbiosis y algunos aspectos de la gestión de la microbiota para mejorar estas afecciones gastrointestinales.
La relación entre microbiota y diarrea
La diarrea puede implicar a numerosos mecanismos (cuadro 1), la mayoría de los cuales están relacionados con la función de la microbiota:
- Protección del equilibrio microbiano. Este estado, conocido como eubiosis, es fundamental para la salud del cuerpo humano, porque previene y ralentiza la expansión de patógenos. La alteración del equilibrio entre las principales cepas microbianas, conocida como disbiosis, puede aumentar la susceptibilidad a las infecciones y contribuir a la diarrea. En general, las publicaciones indican que la diarrea representa una disbiosis importante, y que el grado de disbiosis está relacionado con la etiología y la fase de la diarrea [6]. Tras una diarrea aguda, la taxonomía de la microbiota cambia considerablemente. En las fases tempranas de la diarrea, los anaerobios facultativos de crecimiento rápido como Proteobacterias (principalmente Enterobacteriaceae/ Escherichia coli) y Streptococcus (principalmente Streptococcus salivarius y Streptococcus gallolyticus) dominan y favorecen la desaparición drástica de los comensales anaerobios estrictos del intestino (Blautia, Prevotella, Faecalibacterium, Lachnospiraceae, Ruminococcaceae, etc.) [2, 3]. La consecuencia es que los ácidos grasos de cadena corta (AGCC) también disminuyen, y la integridad de la barrera intestinal empieza a verse amenazada, lo que es posible que produzca permeabilidad intestinal. En la etapa de recuperación después de la diarrea, un modelo propuesto muestra que en la fase intermedia hay una abundancia de Bacteroides (el 7o día desde la aparición de la enfermedad). Al mismo tiempo, en la fase tardía, dominan Prevotella y Firmicutes, productores de AGCC [4, 5]
- Protección contra invasores patógenos. La comunidad microbiana de la microbiota intestinal compite por recursos, produce sustancias antimicrobianas y actúa como una barrera contra los enteropatógenos Se ha demostrado que bacterias beneficiosas, como ciertas cepas de Bifidobacteria y Lactobacilli, tienen efectos beneficiosos en la diarrea infecciosa causada por rotavirus en niños pequeños. Sin embargo, no se han realizado ensayos clínicos que lo demuestren [6].
- Regulación del sistema inmunitario. La microbiota intestinal ayuda a educar y a modular las respuestas inmunitarias, al promover la tolerancia a sustancias inocuas y la defensa frente a patógenos. La desregulación de la respuesta inmunitaria debida a desequilibrios de la microbiota puede contribuir a la inflamación y a la diarrea. Después de tomar antibióticos frente a una diarrea provocada por Clostridioides difficile, como la vancomicina, se observa una menor abundancia relativa de Bacteroidetes y Firmicutes, mientras que hay un aumento de Proteobacteria y Fusobacterisa, lo que conduce a una disminución del propionato de los AGCC. Esto crea las condiciones para la inflamación [7].
- Mantenimiento de la función y el metabolismo intestinales. Las bacterias beneficiosas fermentan las fibras alimentarias para producir ácidos grasos de cadena corta (AGCC) como acetato, propionato y butirato. Los AGCC ayudan a mantener una mucosa intestinal sana, promueven la absorción de agua y ofrecen una fuente de energía a los colonocitos. Los desequilibrios entre cepas bacterianas pueden afectar a estas funciones y provocar una diarrea funcional causada por la disminución de la producción de AGCC. Una mayor producción favorece la absorción del líquido colónico [8].
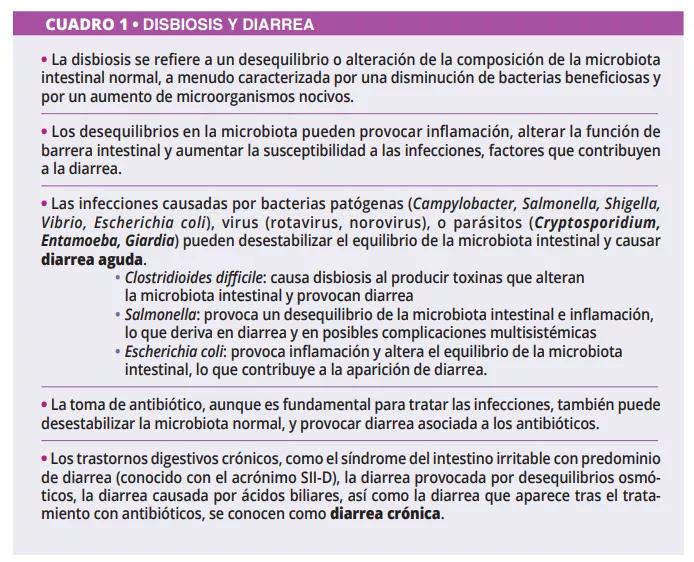
Enfermedades diarreicas y abordaje de la microbiota
Diarrea infecciosa
Las infecciones intestinales bacterianas, víricas o parasitarias provocan diarrea aguda y suelen propagarse a través del agua contaminada. En la mayoría de casos la diarrea mejora en unos pocos días, pero una diarrea intensa puede causar una deshidratación grave y llegar a ser letal [9].
El rotavirus sigue siendo la principal causa de muerte asociada a la diarrea en niños [11], y el tratamiento de esta enfermedad vírica suele consistir en hidratación oral o intravenosa, según la gravedad de la deshidratación [12]. Además, basándose en las últimas conclusiones del comité de la ESPGHAN (2023) [13], los profesionales sanitarios podrían sugerir ciertas cepas probióticas para los episodios gastroentéricos agudos en niños, reconociendo su potencial (nivel de la evidencia: baja; grado de recomendación: débil) para disminuir la duración de la diarrea, y/o la estancia hospitalaria, y/o el volumen de descarga fecal. Sin embargo, un ensayo aleatorizado, controlado y con doble ciego, de niños bolivianos con diarrea aguda por rotavirus, demostró una disminución de la duración de la diarrea mediante el uso de una solución de rehidratación oral más una mezcla de probióticos en comparación con una solución de hidratación simple [11].
Diarrea del turista
Más del 60 % de los adultos de países desarrollados que viajan a países en desarrollo padecen diarrea aguda, también conocida como diarrea del turista (DT). Los patógenos identificados con mayor frecuencia en episodios de diarrea del turista son Escherichia coli, Campylobacter jejuni, y Salmonella spp y Shigella spp. Por lo tanto, las estrategias de tratamiento recomendadas incluyen el tratamiento antibiótico con azitromicina o fluoroquinolonas para los casos moderados a graves [14]. Sin embargo, los antibióticos no están recomendados para evitar la DT, debido a la insuficiencia de pruebas de su eficacia profiláctica y, en parte, al riesgo de resistencia a los antibióticos [15].
Existen datos contradictorios sobre la eficacia de los probióticos en la prevención de la diarrea del turista [16]. Una revisión sistemática y un metanálisis compararon la eficacia de la rifaximina y los probióticos en la prevención de la DT [15].
Diarrea asociada a antibióticos
Los antibióticos son uno de los medicamentos más recetados, y son un tratamiento eficaz para numerosas patologías infecciosas [17]. Una de las complicaciones asociadas con la terapia antibiótica es la diarrea asociada a antibióticos (DAA), que se produce en el 5 %-35 % de los pacientes que reciben tratamiento con antibióticos [18]. La DAA se puede definir como tres o más deposiciones acuosas o blandas al día durante al menos dos días consecutivos, que estén relacionadas estrictamente con la toma de antibióticos y no tengan ninguna otra causa [16]. El riesgo más alto se atribuye a las aminopenicilinas, las cefalosporinas y la clindamicina, que atacan principalmente a los anaerobios [19].
La falta de un agente infeccioso identificado en la DAA puede explicarse por el efecto tóxico directo de los antibióticos en la mucosa intestinal, que puede causar diarrea. Debido a sus propiedades beneficiosas, se están investigando y utilizando probióticos tanto para el tratamiento como para la profilaxis de la DAA [16, 18].
Diarrea asociada a Clostridioides difficile
La infección por Clostridioides difficile (CD) es la causa más frecuente de diarrea nosocomial asociada a antibióticos en adultos. Los factores de riesgo son una edad superior a los 65 años, una hospitalización prolongada en cuidados intensivos y la administración de antibióticos (fluoroquinolonas, clindamicina, cefalosporinas y betalactámicos en particular) o de inhibidores de la bomba de protones.
Durante el tratamiento con antibióticos, los anaerobios que producen AGCC pueden desaparecer debido a las alteraciones de la microbiota intestinal provocadas por los antibióticos, que además pueden perturbar el metabolismo de los hidratos de carbono y la bilis y provocar un desequilibrio osmótico. Tras la toma de antibióticos, las tres barreras intestinales se ven afectadas: las células intestinales epiteliales, la capa de mucosidad y péptidos antimicrobianos, y la capa inmunoprotectora compuesta por distintas células inmunitarias y diferentes biomoléculas (figura 1). Este evento puede interferir con la producción de mucinas, citocinas y péptidos antimicrobianos, desestabilizando la función intestinal y dando lugar a otras infecciones o incluso causando episodios recurrentes de infecciones. La Asociación Americana de Gastroenterología (AGA) recomienda con reservas probióticos específicos para prevenir la infección por CD en pacientes que toman antibióticos, y señala que la calidad de los datos probatorios es baja [20].
Nuevos descubrimientos y el futuro del abordaje de la diarrea
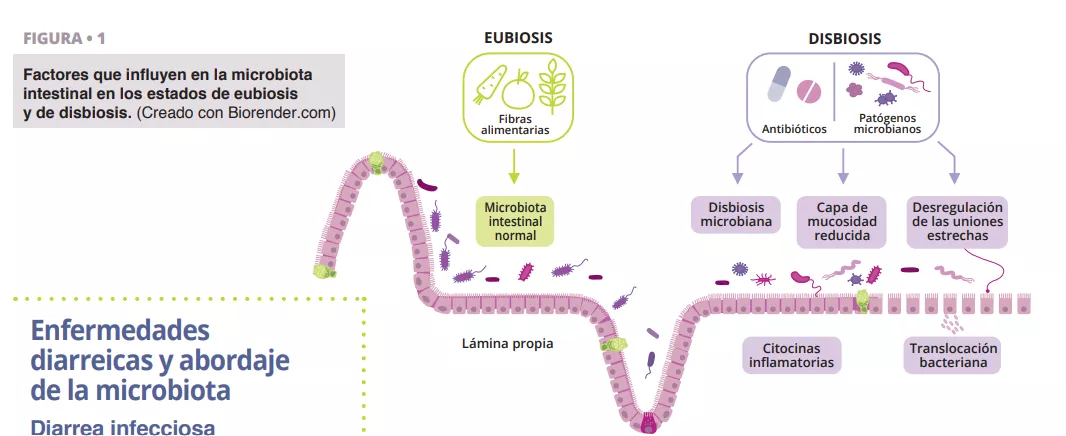
Avances recientes en la investigación de la microbiota, como el análisis metagenómico y el trasplante microbiano están revolucionando nuestro enfoque del abordaje de la diarrea (figura 2).
Las opciones de tratamiento de la diarrea deben tener en cuenta los mecanismos causales implicados en la génesis de la diarrea, desde toxinas infecciosas capaces de alterar el equilibrio de líquidos y electrolitos hasta pacientes que presentan disbiosis por otras causas y pacientes con grandes cantidades de hidratos de carbono no absorbidos en el lumen que provocan una diarrea osmótica.
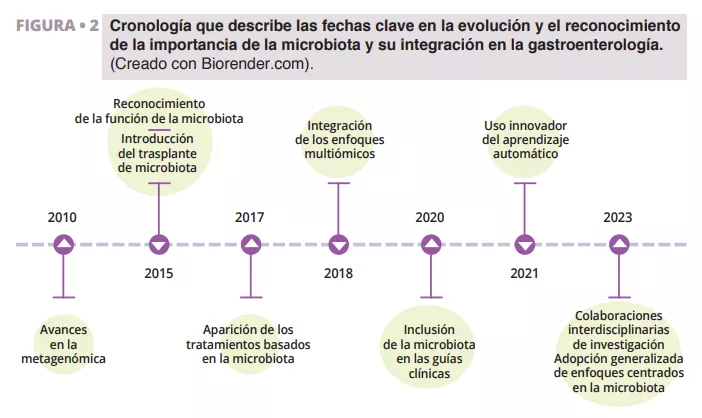
Hay pocos datos sobre los prebióticos y las fibras para el tratamiento de la diarrea (cuadro 2). Parece ser que los prebióticos son más indicados para prevenir y tratar las diarreas recidivantes. Al mismo tiempo, las fibras, principalmente las viscosas, están más indicadas durante los episodios agudos, debido a su capacidad de retención de agua. Otras opciones terapéuticas implican, en algunos casos, la toma de probióticos y (cuadro 3), en casos graves, el uso del trasplante de microbiota fecal (TMF).
La fascinante trayectoria del descubrimiento del TMF se remonta a la antigua China, donde Ge Hong trataba a los pacientes con diarrea grave con una “sopa amarilla” que consistía en una suspensión de heces. Más recientemente, el Dr. Ben Eiseman utilizó enemas fecales de personas sanas para tratar enterocolitis pseudomembranosa en 1958. En la actualidad, existe un creciente interés por el trasplante de microbiota fecal (TMF) como tratamiento para la infección recidivante por Clostridioides difficile (CDI), lo que pone de manifiesto su utilidad [22]. Se está investigando su eficacia en enfermedades inflamatorias intestinales, diabetes, cáncer, cirrosis hepática y enfermedades cerebrales como el Parkinson [23]. Los beneficios de usar el TMF en pacientes con diarrea se basan en la idea de que la flora microbiana sana introducida mediante el TMF tiene la capacidad de superar a los patógenos y de restablecer la composición de un microbioma intestinal sano (figura 3).


Conclusión
Las investigaciones revelan que una diversidad reducida de la microbiota intestinal se asocia con un aumento de la susceptibilidad a la diarrea, lo que abre el camino a posibles intervenciones diagnósticas y terapéuticas. El mantenimiento de una microbiota intestinal equilibrada y diversa previene la diarrea y promueve la salud digestiva general. Los desequilibrios en la microbiota, conocidos como disbiosis, pueden derivar de una diarrea aguda infecciosa o de una disbiosis causada por otros factores (uso frecuente de antibióticos, alimentación poco saludable, absorción insuficiente) que pueden contribuir a una diarrea crónica. Es fundamental entender la compleja interacción entre la composición microbiana y los síntomas clínicos para un abordaje personalizado de la diarrea. Los enfoques personalizados basados en perfiles únicos de la microbiota pueden llevar a estrategias o intervenciones más eficaces. La introducción de probióticos y de una alimentación rica en prebióticos, el trasplante de microbiota, la integración de enfoques multiómicos, el uso innovador del aprendizaje automático, y la creciente tendencia de colaboraciones interdisciplinarias de investigación pueden ayudar a restablecer el equilibrio microbiano y a favorecer el bienestar gastrointestinal. Es de esperar que en el futuro podamos diseñar tratamientos basados en el microbioma, como sugiere Peter J. Turnbaugh, y así sentar las bases de nuevos principios de tratamiento [25].
1. Iancu MA, Profir M, Roşu OA, et al. Revisiting the Intestinal Microbiome and Its Role in Diarrhea and Constipation. Microorganisms 2023; 11: 2177.
2. David L, Weil A, Ryan ET, et al. Gut microbial succession follows acute secretory diarrhea in humans. mBio 2015; 6: 1-14.
3. Sohail MU, Al Khatib HA, Al Thani AA, et al. Microbiome profiling of rotavirus infected children suffering from acute gastroenteritis. Gut Pathog 2021; 13: 21.
4. Becker-Dreps S, Allali I, Monteagudo A, et al. Gut Microbiome Composition in Young Nicaraguan Children During Diarrhea Episodes and Recovery. Am J Trop Med Hyg 2015; 93: 1187-93.
5. Cannon JL, Seabolt MH, Xu R, et al. Gut Microbiome Changes Occurring with Norovirus Infection and Recovery in Infants Enrolled in a Longitudinal Birth Cohort in Leon, Nicaragua. Viruses 2022; 14: 1395.
6. Azagra-Boronat I, Massot-Cladera M, Knipping K, et al. Strain-Specific Probiotic Properties of Bifidobacteria and Lactobacilli for the Prevention of Diarrhea Caused by Rotavirus in a Preclinical Model. Nutrients 2020; 12: 498.
7. Kim AH, Lee Y, Kim E, et al. Assessment of oral vancomycin-induced alterations in gut bacterial microbiota and metabolome of healthy men. Front Cell Infect Microbiol 2021; 11: 629438.
8. Binder HJ. Role of colonic short-chain fatty acid transport in diarrhea. Annu Rev Physiol 2010; 72: 297-313.
9. Collinson S, Deans A, Padua-Zamora A, et al. Probiotics for treating acute infectious diarrhoea. Cochrane Database Syst Rev 2020; 12:CD003048.
10. Desselberger U. Viral gastroenteritis. Medicine 2017; 45: 690-4.
11. GBD 2016 Diarrheal Disease Collaborators. Estimates of the global, regional, and national morbidity, mortality, and aetiologies of diarrhea in 195 countries: a systematic analysis for the Global Burden of Disease Study 2016. Lancet Infect Dis 2018; 18: 1211-8.
12. Iturriza-Gómara M, Cunliffe NA. 34 - Viral Gastroenteritis. Ryan ET, Hill DR, Solomon T, Aronson NE, Endy TP. (eds) Hunter’s Tropical Medicine and Emerging Infectious Diseases (tenth edition). Elsevier, 2020, pp. 289-307.
13. Szajewska H, Berni Canani R, Domellöf M et al.; ESPGHAN Special Interest Group on Gut Microbiota and Modifications. Probiotics for the Management of Pediatric Gastrointestinal Disorders: Position Paper of the ESPGHAN Special Interest Group on Gut Microbiota and Modifications. J Pediatr Gastroenterol Nutr 2023; 76: 232-47.
14. Kopacz K, Phadtare S. Probiotics for the Prevention of antibiotic-associated diarrhea. Healthcare 2022; 10: 1450.
15. Fan H, Gao L, Yin Z, et al. Probiotics and rifaximin for the prevention of travelers’ diarrhea: A systematic review and network meta-analysis. Medicine 2022; 101: e30921.
16. Girardin M, Seidman EG. Indications for the use of probiotics in gastrointestinal diseases. Dig Dis 2011; 29: 574-87.
17. Goodman C, Keating G, Georgousopoulou E, et al. Probiotics for the prevention of antibiotic-associated diarrhoea: a systematic review and meta-analysis. BMJ Open 2021; 11: e043054.
18. McFarland LV. Antibiotic-associated diarrhea: epidemiology, trends and treatment. Future Microbiol 2008; 3: 563-78.
19. Barbut F, Meynard JL. Managing antibiotic associated diarrhoea. BMJ 2002; 324: 1345-6.
20. Su GL, Ko CW, Bercik P, et al. AGA Clinical Practice Guidelines on the Role of Probiotics in the Management of Gastrointestinal Disorders. Gastroenterology 2020; 159: 697-705.
21. Codex AC. Report of the 31th session of the codex committee on nutrition and foods for special dietary uses. Rome, Italy: FAO/WHO 2009.
22. Peery AF, Kelly CR, Kao D, et al.; AGA Clinical Guidelines Committee. AGA Clinical Practice Guideline on Fecal Microbiota-Based Therapies for Select Gastrointestinal Diseases. Gastroenterology 2024; 166: 409-34.
23. Tariq R, Disbrow MB, Dibaise JK, etal. Efficacy of Fecal Microbiota Transplantation for Recurrent C. Difficile Infection in Inflammatory Bowel Disease. Inflamm Bowel Dis 2020; 26: 1415-20.
24. Guarino A, Ashkenazi S, Gendrel D, et al. European Society for Pediatric Gastroenterology, Hepatology, and Nutrition/European Society for Pediatric Infectious Diseases evidence-based guidelines for the management of acute gastroenteritis in children in Europe: update 2014. J Pediatr Gastroenterol Nutr 2014; 59: 132-52.
25. Rock RR, Turnbaugh PJ. Forging the microbiome to help us live long and prosper. PLoS Biol 2023; 21: e3002087.

