Диарея и роль микробиоты
Д-р Санда Мария КретойуКафедра морфологических наук, клеточной
и молекулярной биологии и гистологии, Медицинский и фармацевтический университет «Кэрол Давила», Бухарест, Румыния
Раздел для широкой публики
Найдите здесь свое выделенное место
en_sources_title
en_sources_text_start en_sources_text_end
Делиться - значит заботиться
Возможно, эта тема заинтересует ваших коллег. Почему бы не поделиться ею?
Разделы

Об этой статье
Нарушения со стороны кишечника могут проявляться таким симптомом, как диарея, то есть частым и жидким стулом. Этот сигнал от пищеварительной системы может возникать по многим причинам: инфекции и реакции на определенные продукты, побочные реакции на лекарственные препараты, предсуществующие заболевания [1]. Кишечная микробиота, то есть совокупность микроорганизмов, присутствующих в кишечнике, имеет важное значение для сохранения здоровья пищеварительной системы благодаря своему влиянию на функционирование кишечника. Недавние исследования показали связь между микробиотой и диареей различной этиологии. Сбалансированная и разнообразная микробиота жизненно важна для общего здоровья пищеварительной системы, усвоения питательных веществ и функционирования иммунной системы. Сейчас наблюдается тенденция к масштабному внедрению способов перепрограммирования кишечного микробного сообщества (пребиотики, пробиотики и постбиотики или трансплантация фекалий) с целью профилактики или лечения диареи. В ближайшем будущем исследования по модуляции микробиоты смогут предложить действенные стратегии профилактики и лечения диареи. Этот обзор охватывает основные заболевания, проявляющиеся диареей и связанные с дисбиозом, а также некоторые аспекты, касающиеся воздействия на микробиоту с целью облегчения желудочно-кишечных расстройств.
Связь между микробиотой и диареей
Диарея может быть обусловлена различными механизмами (таблица 1), большинство из которых связаны с микробиотой:
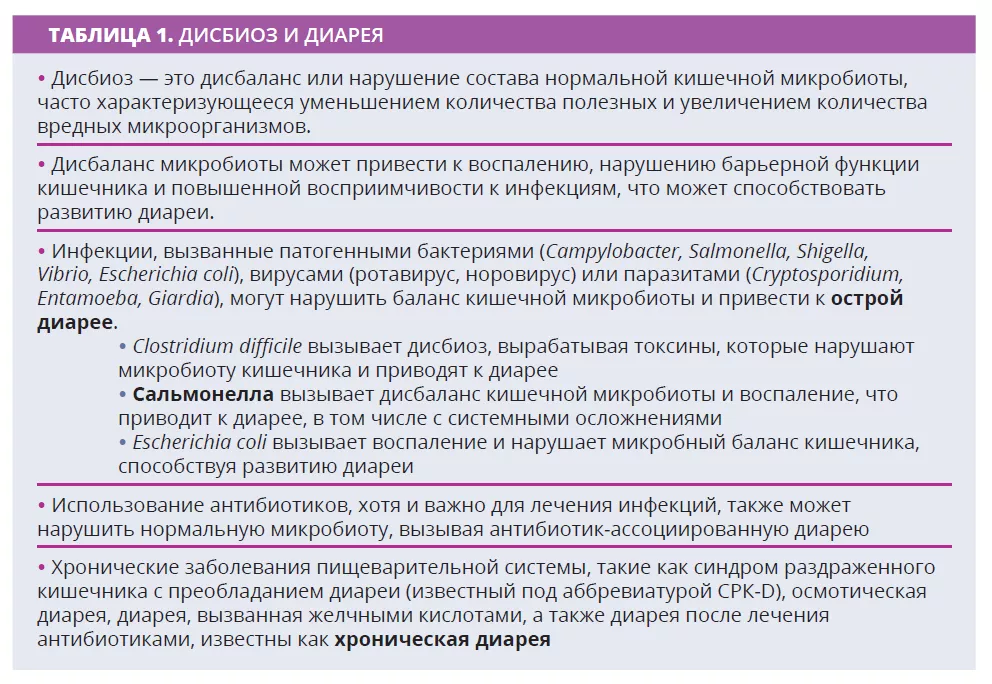
- Защита микробного баланса, состояния, известного как эубиоз, имеет основополагающее значение для здоровья человека, так как предотвращает и замедляет распространение патогенов. Нарушение баланса между основными микробными штаммами, известное как дисбиоз, может повысить восприимчивость к инфекциям и способствовать возникновению диареи. В литературе обычно указывается, что диарея представляет собой серьезный дисбиоз и что степень дисбиоза связана с этиологией и стадией диареи [6]. После острой диареи таксономический состав микробиоты сильно меняется. На ранних стадиях диареи доминируют факультативные быстрорастущие анаэробы, такие как Proteobacteria (в основном Enterobacteriaceae / Escherichia coli) и Streptococcus (в основном Streptococcus salivarius и Streptococcus gallolyticus), которые способствуют резкому исчезновению облигатных анаэробных комменсалов кишечника (Blautia, Prevotella, Faecalibacterium, Lachnospiraceae, Ruminococcaceae и т. д.) [2, 3]. В результате снижаются уровни короткоцепочечных жирных кислот (КЦЖК) и нарушается целостность кишечного барьера, что может привести к повышению проницаемости кишечника. В фазе восстановления после диареи предлагаемая модель показывает, что в средней стадии (7-й день с момента начала заболевания) наблюдается преобладание Bacteroides. На поздних стадиях доминируют Prevotella и КЦЖК-продуцирующие Firmicutes [4, 5].
- Защита от патогенных микробов. Микробное сообщество кишечной микробиоты конкурирует за ресурсы, вырабатывает противомикробные вещества и действует как барьер против энтеропатогенов. Доказано, что полезные бактерии в кишечнике, такие как некоторые штаммы Bifidobacteria and Lactobacilli, оказывают положительные эффекты у детей младшего возраста при инфекционной диарее, вызванной ротавирусом. Однако клинические исследования, подтверждающие это, отсутствуют [6].
- Регуляция иммунной системы. Кишечная микробиота помогает обучать и модулировать иммунные реакции, повышая толерантность к безвредным веществам и защищая от патогенов. Нарушение регуляции иммунного ответа из-за дисбаланса микробиоты может способствовать развитию воспаления и диареи. После лечения диареи, вызванной Clostridioides difficile, с помощью антибиотиков, таких как ванкомицин, наблюдается снижение относительной численности Bacteroidetes и Firmicutes и увеличение численности Proteobacteria и Fusobacteria, что приводит к снижению продукции КЦЖК пропионата и создает предпосылки для воспаления [7].
- Поддержание функций кишечника и метаболизма. Полезные бактерии ферментируют пищевые волокна с образованием короткоцепочечных жирных кислот (КЦЖК), таких как ацетат, пропионат и бутират. КЦЖК способствуют поддержанию здоровья слизистой оболочки кишечника, поглощению воды и являются источником энергии для колоноцитов (эпителиальных клеток слизистой кишечника). Дисбаланс между бактериальными штаммами может влиять на эти функции, что приводит к функциональной диарее из-за снижения продукции КЦЖК. Увеличение их продукции усиливает всасывание воды в толстой кишке. [8].
Заболевания, проявляющиеся диареей, и воздействие на микробиоту.
Инфекционная диарея
Бактериальные, вирусные или паразитарные инфекции кишечника вызывают острую диарею и часто распространяются через загрязненную воду. В большинстве случаев симптомы диареи улучшаются в течение нескольких дней, но тяжелая диарея может привести к серьезному обезвоживанию и даже смерти [9].
Ротавирусы остаются основной причиной смерти детей от диареи [11]. Лечение этого вирусного заболевания обычно включает пероральную или внутривенную гидратацию в соответствии с тяжестью обезвоживания [12]. На основании последнего заключения комитета ESPGHAN (2023) [13], поставщики медицинских услуг могут предложить определенные пробиотические штаммы при остром гастроэнтерите у детей — это подтверждает их возможность (достоверность доказательств: низкая; степень рекомендации: слабая) уменьшать продолжительность диареи и/или пребывания в больнице и/или объема диареи. Однако, результаты рандомизированного пластинкадвойного слепого контролируемого исследования боливийских детей с острой ротавирусной диареей показали уменьшение продолжительности диареи при использовании комбинации раствор для пероральной регидратации плюс смесь пробиотиков по сравнению с только раствором для пероральной регидратации [11].
Диарея путешественников
Более 60% взрослых людей из развитых стран, путешествующих в развивающиеся страны, испытывают острую диарею, также известную как диарея путешественников (ДП). Наиболее часто выявляемыми патогенами в таком случае являются Escherichia coli, Campylobacter jejuni, виды Salmonella и Shigella. Рекомендуемые стратегии лечения включают антибиотикотерапию азитромицином или фторхинолонами при умеренных и тяжелых эпизодах [14]. Однако, антибиотики — не лучший вариант для профилактики ДП в связи с недоказанностью их профилактической эффективности и, отчасти, из-за риска развития антибиотикорезистентности [15].
Имеются противоречивые данные относительно эффективности пробиотиков в качестве средства профилактики диареи путешественников [16]. В одном систематическом обзоре и метаанализе сравнивали эффективность рифаксимина и пробиотиков в профилактике ДП. [15].
Антибиотик-ассоциированная диарея
Антибиотики — одни из наиболее часто назначаемых лекарственных средств. Они позволяют эффективно бороться со многими инфекционными заболеваниями [17]. Одним из осложнений антибиотикотерапии является антибиотик-ассоциированная диарея (ААД), которая встречается у 5-35% пациентов, получающих антибиотики [18]. ААД можно определить как наличие трех или более эпизодов водянистого или жидкого стула в день минимум два дня подряд, строго связанных с применением антибиотиков и не имеющих другой причины [14]. Самый высокий риск связан с аминопенициллинами, цефалоспоринами и клиндамицином, которые в первую очередь нацелены на анаэробы [19].
Отсутствие идентифицируемого инфекционного агента при ААД можно объяснить прямым токсическим действием антибиотиков на слизистую оболочку кишечника, что может вызвать диарею. Благодаря своим полезным свойствам пробиотики в настоящее время исследуются и используются как для лечения, так и для профилактики ААД [16, 18].
Clostridium difficile-ассоциированная диарея
Инфекция, вызванная Clostridioides difficile (CD), является наиболее частой причиной внутрибольничной антибиотик-ассоциированной диареи у взрослых. Факторы риска включают возраст старше 65 лет, длительное нахождение в отделении интенсивной терапии и назначение антибиотиков (в частности, фторхинолонов, клиндамицина, цефалоспоринов и бета-лактамов) или ингибиторов протонной помпы.
Во время антибиотикотерапии анаэробы, продуцирующие КЦЖК, могут исчезнуть из-за вызванных антибиотиками изменений в кишечной микробиоте, которые также могут нарушать метаболизм углеводов и желчи и вызывать осмотический дисбаланс. Антибиотики влияют на все три кишечных барьера: эпителиальные клетки, слой слизи и антимикробных пептидов и иммунопротекторный слой, состоящий из различных иммунных клеток и биомолекул (рисунок 1). В результате могут нарушаться выработка муцина, цитокинов и антимикробных пептидов, функции кишечника, возникать другие инфекции или даже рецидивирующие эпизоды инфекций. Американская гастроэнтерологическая ассоциация (AGA) условно рекомендует определенные пробиотики для профилактики CD-ассоциированной инфекции у лиц, получающих антибиотики, хотя и отмечает низкое качество доказательств [20].
Новые открытия и будущее лечения диареи
Недавние прорывы в исследованиях микробиоты, включая метагеномный анализ и микробную трансплантацию, могут кардинально изменить подходы к лечению диареи (рисунок 2).
Подходы к лечению диареи должны учитывать причинно-следственные механизмы, участвующие в развитии диареи, начиная от инфекционных токсинов, способных нарушать водный и электролитный баланс, до пациентов, у которых дисбиоз развился по другим причинам, и пациентов, у которых наличие большого количества неперевариваемых углеводов в просвете кишечника вызывает осмотическую диарею.
Имеются ограниченные данные о применении пребиотиков и клетчатки в лечении диареи (таблица 2). По-видимому, пребиотики более подходят для профилактики и лечения рецидивирующей диареи. В то же время пищевые волокна, в основном нетвердые, более показаны во время острых эпизодов благодаря их способности удерживать воду. Другие варианты лечения включают, в некоторых случаях, использование пробиотиков и (таблица 3), в тяжелых случаях, трансплантацию фекальной микробиоты (ТФМ).
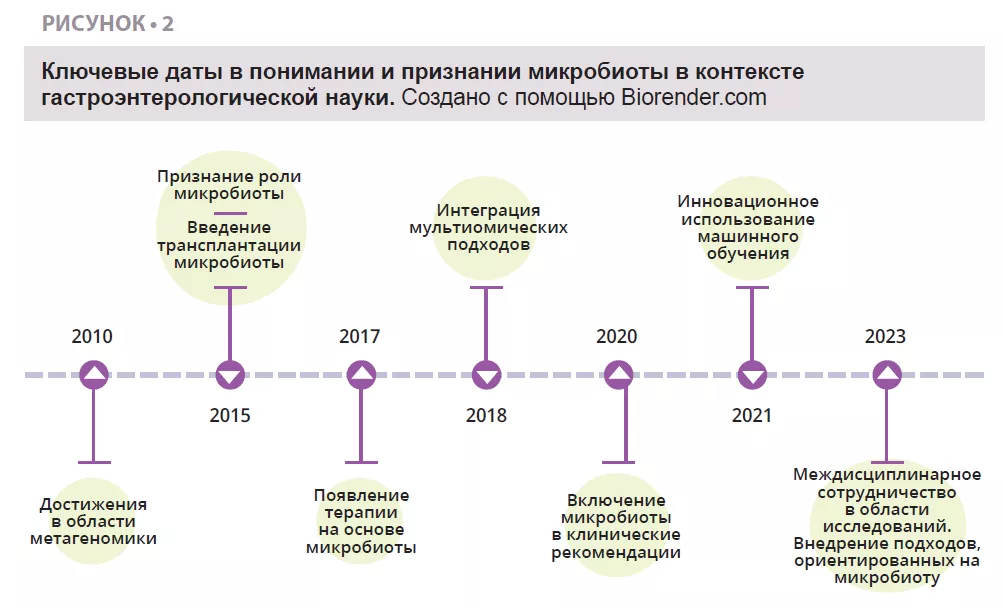
История открытия ТФМ уходит корнями в древний Китай, где Ге Хун лечил пациентов с тяжелой диареей с помощью «желтого супа», состоящего из фекалий. В новое время доктор Бен Айзман использовал клизмы с фекалиями здоровых людей для лечения псевдомембранозного энтероколита еще в 1958 году. В настоящее время растет интерес к трансплантации фекальной микробиоты (ТФМ) как методу лечения рецидивирующей инфекции, вызванной Clostridioides difficile (CDI), что указывает на ее полезность [22]. Продолжаются исследования по оценке эффективности ТФМ при воспалительных заболеваниях кишечника, сахарном диабете, онкологических заболеваниях, циррозе печени и заболеваниях головного мозга (болезнь Паркинсона) [23]. Убеждение в пользе ТФМ при диарее основано на идее, что здоровая микробная флора в составе фекального трансплантата способна вытеснить патогены и восстановить здоровый состав кишечного микробиома (рисунок 3).


Заключение
Исследования показывают, что уменьшение разнообразия кишечной микробиоты связано с повышенным риском возникновения диареи, что открывает возможности для разработки новых методов диагностики и лечения. Поддержание сбалансированной и разнообразной кишечной микробиоты помогает предотвратить диарею и сохранить здоровье пищеварительной системы в целом. Дисбаланс микробиоты, известный как дисбиоз, может быть результатом инфекционной острой диареи или дисбиоза вследствие других факторов (частое использование антибиотиков, нездоровое питание, мальабсорбция), которые могут способствовать развитию хронической диареи. Понимание сложных взаимосвязей между микробным составом и клиническими симптомами имеет решающее значение для персонализированного лечения диареи. Индивидуальные подходы, основанные на уникальных профилях микробиоты, могут привести к созданию более эффективных стратегий или вмешательств. Внедрение пробиотиков и диеты, богатой пребиотиками, трансплантация микробиоты, интеграция мультиомических подходов, инновационное использование машинного обучения и растущая тенденция к междисциплинарному научному сотрудничеству могут помочь восстановить микробный баланс и сохранить здоровье желудочно-кишечного тракта. Есть надежда, что в будущем удастся разработать методы лечения на основе микробиома, как предложил Питер Дж. Тернбо, заложив основу для новых принципов лечения [25].
1. Iancu MA, Profir M, Roşu OA, et al. Revisiting the Intestinal Microbiome and Its Role in Diarrhea and Constipation. Microorganisms 2023; 11: 2177.
2. David L, Weil A, Ryan ET, et al. Gut microbial succession follows acute secretory diarrhea in humans. mBio 2015; 6: 1-14.
3. Sohail MU, Al Khatib HA, Al Thani AA, et al. Microbiome profiling of rotavirus infected children suffering from acute gastroenteritis. Gut Pathog 2021; 13: 21.
4. Becker-Dreps S, Allali I, Monteagudo A, et al. Gut Microbiome Composition in Young Nicaraguan Children During Diarrhea Episodes and Recovery. Am J Trop Med Hyg 2015; 93: 1187-93.
5. Cannon JL, Seabolt MH, Xu R, et al. Gut Microbiome Changes Occurring with Norovirus Infection and Recovery in Infants Enrolled in a Longitudinal Birth Cohort in Leon, Nicaragua. Viruses 2022; 14: 1395.
6. Azagra-Boronat I, Massot-Cladera M, Knipping K, et al. Strain-Specific Probiotic Properties of Bifidobacteria and Lactobacilli for the Prevention of Diarrhea Caused by Rotavirus in a Preclinical Model. Nutrients 2020; 12: 498.
7. Kim AH, Lee Y, Kim E, et al. Assessment of oral vancomycin-induced alterations in gut bacterial microbiota and metabolome of healthy men. Front Cell Infect Microbiol 2021; 11: 629438.
8. Binder HJ. Role of colonic short-chain fatty acid transport in diarrhea. Annu Rev Physiol 2010; 72: 297-313.
9. Collinson S, Deans A, Padua-Zamora A, et al. Probiotics for treating acute infectious diarrhoea. Cochrane Database Syst Rev 2020; 12:CD003048.
10. Desselberger U. Viral gastroenteritis. Medicine 2017; 45: 690-4.
11. GBD 2016 Diarrheal Disease Collaborators. Estimates of the global, regional, and national morbidity, mortality, and aetiologies of diarrhea in 195 countries: a systematic analysis for the Global Burden of Disease Study 2016. Lancet Infect Dis 2018; 18: 1211-8.
12. Iturriza-Gómara M, Cunliffe NA. 34 - Viral Gastroenteritis. Ryan ET, Hill DR, Solomon T, Aronson NE, Endy TP. (eds) Hunter’s Tropical Medicine and Emerging Infectious Diseases (tenth edition). Elsevier, 2020, pp. 289-307.
13. Szajewska H, Berni Canani R, Domellöf M et al.; ESPGHAN Special Interest Group on Gut Microbiota and Modifications. Probiotics for the Management of Pediatric Gastrointestinal Disorders: Position Paper of the ESPGHAN Special Interest Group on Gut Microbiota and Modifications. J Pediatr Gastroenterol Nutr 2023; 76: 232-47.
14. Kopacz K, Phadtare S. Probiotics for the Prevention of antibiotic-associated diarrhea. Healthcare 2022; 10: 1450.
15. Fan H, Gao L, Yin Z, et al. Probiotics and rifaximin for the prevention of travelers’ diarrhea: A systematic review and network meta-analysis. Medicine 2022; 101: e30921.
16. Girardin M, Seidman EG. Indications for the use of probiotics in gastrointestinal diseases. Dig Dis 2011; 29: 574-87.
17. Goodman C, Keating G, Georgousopoulou E, et al. Probiotics for the prevention of antibiotic-associated diarrhoea: a systematic review and meta-analysis. BMJ Open 2021; 11: e043054.
18. McFarland LV. Antibiotic-associated diarrhea: epidemiology, trends and treatment. Future Microbiol 2008; 3: 563-78.
19. Barbut F, Meynard JL. Managing antibiotic associated diarrhoea. BMJ 2002; 324: 1345-6.
20. Su GL, Ko CW, Bercik P, et al. AGA Clinical Practice Guidelines on the Role of Probiotics in the Management of Gastrointestinal Disorders. Gastroenterology 2020; 159: 697-705.
21. Codex AC. Report of the 31th session of the codex committee on nutrition and foods for special dietary uses. Rome, Italy: FAO/WHO 2009.
22. Peery AF, Kelly CR, Kao D, et al.; AGA Clinical Guidelines Committee. AGA Clinical Practice Guideline on Fecal Microbiota-Based Therapies for Select Gastrointestinal Diseases. Gastroenterology 2024; 166: 409-34.
23. Tariq R, Disbrow MB, Dibaise JK, etal. Efficacy of Fecal Microbiota Transplantation for Recurrent C. Difficile Infection in Inflammatory Bowel Disease. Inflamm Bowel Dis 2020; 26: 1415-20.
24. Guarino A, Ashkenazi S, Gendrel D, et al. European Society for Pediatric Gastroenterology, Hepatology, and Nutrition/European Society for Pediatric Infectious Diseases evidence-based guidelines for the management of acute gastroenteritis in children in Europe: update 2014. J Pediatr Gastroenterol Nutr 2014; 59: 132-52.
25. Rock RR, Turnbaugh PJ. Forging the microbiome to help us live long and prosper. PLoS Biol 2023; 21: e3002087.

