Diyare ve mikrobiyotanın rolü
Dr. Sanda Maria Cretoiu
Morfolojik Bilimler, Hücre ve Moleküler
Biyoloji ve Histoloji Bölümü, "Carol Davila"
Tıp Üniversitesi
ve Eczacılık Bükreş, Romanya
Genel halk için bölüm
Özel alanınızı burada bulun
en_sources_title
en_sources_text_start en_sources_text_end
Bölümler

Bu makale hakkında
Bağırsak rahatsızlıkları, ishal olarak bilinen sık ve sulu dışkı gibi semptomlar gösterebilir. Sindirim sisteminden gelen bu sinyal şu durumlarda ortaya çıkabilir: Enfeksiyonlar ve belirli gıdalara karşı reaksiyonlardan ilaçlara ve önceden var olan sağlık koşullarına karşı advers reaksiyonlara kadar birçok nedenden dolayı ([1]'de özetlenmiştir). Bağırsak mikrobiyotası, yani bağırsakta bulunan mikroorganizmaların bütünü, sindirim sağlığının korunması ve bağırsağın işleyişi üzerindeki etkisi açısından çok önemlidir. Son çalışmalar, mikrobiyota ile farklı etiyolojilere sahip ishaller arasındaki bağlantıyı ortaya koymaktadır. Dengeli ve çeşitli bir mikrobiyota, genel sindirim sağlığı, besin emilimi ve bağışıklık sistemi düzenlemesi için hayati önem taşımaktadır. Şu anda, mikrobiyotaya yönelik bir eğilim vardır: Prebiyotikler, probiyotikler ve postbiyotikler ya da ishali önlemek veya tedavi etmek için dışkı nakli gibi bağırsak mikrobiyal topluluğunu yeniden programlama yollarının geniş ölçekli tanımlanması. Mikrobiyota modülasyonu üzerine yapılan araştırmalar, yakın gelecekte ishalin önlenmesi ve tedavisi için uygulanabilir stratejiler sunacaktır. Aşağıdaki genel bakış, disbiyoz ile ilişkili başlıca ishal hastalıklarını ve bu gastrointestinal rahatsızlıkları iyileştirmek için mikrobiyota yönetimine ilişkin bazı hususları kapsamaktadır.
Mikrobiyota ve diyare arasındaki ilişki
İshal çeşitli mekanizmalar içerebilir (tablo 1) ve bunların çoğu mikrobiyotanı ile ilişkilidir:
- Mikrobiyal dengenin korunması, öbiyosis olarak bilinen bu durum, patojenlerin yayılmasını önlediği ve yavaşlattığı için insan vücudunun sağlığı için bir gerekliliktir. Disbiyoz olarak bilinen ana mikrobiyal suşlar arasındaki dengenin bozulması, enfeksiyonlara duyarlılığı artırabilir ve ishale katkıda bulunabilir. Literatürler genel olarak ishalin önemli bir hastalık olduğunu göstermektedir ve disbiyoz derecesinin ishalin etiyolojisi ve evresi ile ilişkili olduğu belirtilmiştir [6]. Akut ishalin ardından mikrobiyotanın taksonomisi çok değişir. İshalin erken evrelerinde, Proteobacteria (çoğunlukla Enterobacteriaceae/Escherichia coli) ve Streptococcus (çoğunlukla Streptococcus salivarius ve Streptococcus gallolyticus) gibi fakültatif hızlı büyüyen anaeroblar baskındır ve zorunlu anaerobik bağırsak kommensallerinin (Blautia, Prevotella, Faecalibacterium, Lachnospiraceae, Ruminococcaceae, vb.) [2, 3]. Bunun sonucunda kısa zincirli yağ asitleri (SCFA) azalır ve bağırsak bariyerinin bütünlüğü tehdit altına girerek muhtemelen bağırsak geçirgenliğine de yol açar. İshal sonrası iyileşme evresinde, önerilen bir modele göre, bağırsakta orta aşamada, bol miktarda Bakteroid vardır (hastalığın başlangıcından itibaren 7th gün). Aynı zamanda, geç evrede Prevotella ve SCFA üreten Firmicutes baskındır [4, 5].
- Patojenik invasyonlara karşı koruma. Bağırsak mikrobiyotasının mikrobiyal topluluğu kaynaklar için rekabet eder, antimikrobiyal maddeler üretir ve enteropatojenlere karşı bir bariyer görevi görür. Bazı Bifidobacteria ve Lactobacilli türleri gibi bağırsaktaki yararlı bakterilerin, küçük çocuklarda rotavirüsün neden olduğu bulaşıcı ishal üzerinde yararlı etkileri olduğu gösterilmiştir. Ancak bunu gösteren klinik çalışmalar bulunmamaktadır [6].
- Bağışıklık sisteminin düzenlenmesi. Bağırsak mikrobiyotası, zararsız maddelere karşı toleransı ve patojenlere karşı savunmayı teşvik ederek bağışıklık tepkilerinin eğitilmesine ve düzenlenmesine yardımcı olur. Mikrobiyota dengesizlikleri nedeniyle bağışıklık tepkisinin düzensizleşmesi, inflamasyona ve ishale katkıda bulunabilir. Clostridioides difficile kaynaklı ishal için antibiyotik sonrası, vankomisin gibi, Bacteroidetes ve Firmicutes'in göreceli bolluğunda azalma gözlenirken, Proteobacteria ve Fusobacteria artar ve SCFA propiyonatında azalmaya yol açarak inflamasyon için zemin oluşturur [7]
- Bağırsak fonksiyonlarının ve metabolizmasının korunması. Faydalı bakteriler diyet liflerini fermente ederek asetat, pro-piyonat ve bütirat gibi kısa zincirli yağ asitleri (SCFA'lar) üretir. SCFA'lar sağlıklı bir bağırsak duvarının korunmasına katkıda bulunur, su emilimini destekler ve kolonositler için bir enerji kaynağı sağlar. Bakteri suşları arasındaki farklılıklar bu işlevleri etkileyerek SCFA üretiminin azalmasına bağlı olarak fonksiyonel ishale yol açabilir. Üretiminin artırılması kolonik sıvı emilimini artırır. [8].

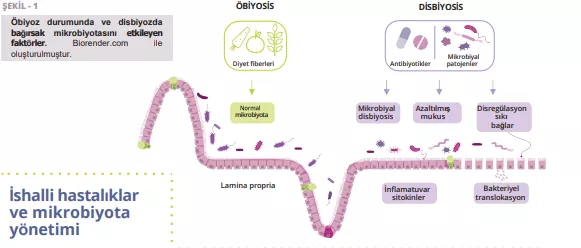
İshalli hastalıklar ve mikrobiyota yönetimi
Enfeksiyöz ishal
Bakteriyel, viral veya parazitik bağırsak enfeksiyonları akut ishale neden olur ve sıklıkla kontamine su yoluyla yayılır. Çoğu ishal vakası birkaç gün içinde iyileşir, ancak şiddetli ishal şiddetli dehidrasyona yol açabilir ve ölümcül olabilir [9].
Rotavirüsler çocuklarda ishale bağlı ölümlerin başlıca nedeni olmaya devam etmektedir [11] ve bu viral hastalığın tedavisi genellikle dehidrasyonun ciddiyetine göre oral veya intravenöz hidrasyonu içermektedir [12]. Ayrıca, ESPGHAN komitesinin son sonuçlarına göre (2023) [13], sağlık hizmeti sağlayıcıları, ishal süresini ve/veya hastanede kalış süresini ve/veya dışkı boşaltım hacmini azaltma potansiyellerini (kanıt kesinliği: düşük; tavsiye derecesi: zayıf) göz önünde bulundurarak, çocuklardaki akut gastroenterik ataklar için belirli probiyotik suşları önerebilir. Bununla birlikte, akut rotavirüs ishali olan Bolivyalı çocuklarda yapılan randomize, çift kör, kontrollü bir çalışma, oral rehidrasyon solüsyonu artı probiyotik karışımı kullanıldığında, basit rehidrasyon solüsyonuna kıyasla ishal süresinde azalma olduğunu göstermiştir [11].
Turist ishali
Gelişmiş ülkelerden gelişmekte olan ülkelere seyahat eden yetişkinlerin %60'ından fazlası, turist ishali (TD) olarak da bilinen akut ishal yaşamaktadır. Turist ishali ataklarında en sık tespit edilen patojenler Escherichia coli, Campylobacter jejuni, Salmonella türleri ve Shigella türleridir. Bu nedenle, önerilen tedavi stratejileri, hafif ila şiddetli vakalar için azitromisin veya florokinolonlarla antibiyotik tedavisini içerir [14]. Bununla birlikte, antibiyotikler, TD'yi önlemede profilaktik etkinliğine ilişkin yeterli kanıt bulunmadığından ve kısmen de antibiyotik direncini arttırma riski nedeniyle [15] önerilmemektedir.
Probiyotiklerin turist ishalini önlemedeki etkinliğine ilişkin çelişkili veriler bulunmaktadır [16]. Bir sistematik inceleme ve meta-analiz, TD'yi önlemede rifaksimin ve probiyotiklerin etkinliğini karşılaştırmıştır [15].
Antibiyotik ilişkili ishal
Antibiyotikler en çok reçete edilen ilaçlardan biridir ve çeşitli enfeksiyon patolojileri için etkili bir tedaviyi temsil etmektedir [17]. Antibiyotik tedavisiyle ilişkili komplikasyonlardan biri, antibiyotik tedavisi alan hastaların %5- %35'inde görülen anti-biyotik ilişkili ishaldir (AAD) [18]. AAD, en az iki ardışık gün boyunca günde üç veya daha fazla sulu veya şekilsiz dışkılama olarak tanımlanabilir ve bu durum kesinlikle antibiyotik uygulamasına bağlıdır ve başka bir nedeni yoktur [14]. En yüksek risk, öncelikle anaerobları hedef alan aminopenisilinler, sefalosporinler ve klindamisine atfedilmektedir [19].
AAD'de enfeksiyöz bir ajanın tespit edilememesi, antibiyotiklerin bağırsak mukozası üzerinde ishale neden olabilecek doğrudan toksik etkisi ile açıklanabilir. Yararlı özellikleri nedeniyle probiyotikler günümüzde AAD'nin hem tedavisi hem de profilaksisi için araştırılmakta ve kullanılmaktadır [16, 18].
Clostridium difficile- ilişkili ishal
Clostridioides difficile (CD) enfeksiyonu, yetişkinlerde nozokomiyal antibiyotik ilişkili diyarenin en yaygın nedenidir. Risk faktörleri arasında 65 yaşın üzerinde olmak, yoğun bakımda uzun süre yatmak ve antibiyotik (özellikle florokinolonlar, klindamisin, sefalosporinler ve beta-laktamlar) veya proton pompası inhibitörleri kullanmak yer almaktadır. Antibiyoterapi sırasında, bağırsak mikrobiyotasında antibiyotik kaynaklı değişiklikler nedeniyle SCFA üreten anaeroblar ortadan kalkabilir, bu da karbonhidrat ve safra metabolizmasını bozabilir ve ozmotik bir dengesizliğe neden olabilir. Antibiyotik alımının ardından üç bağırsak bariyeri de etkilenir: bağırsak epitel hücreleri, mukus ve antimikrobiyal peptid tabakası ve farklı bağışıklık hücreleri ve çeşitli biyomoleküllerden oluşan bağışıklık koruyucu tabaka (Şekil 1). Bu olay müsin, sitokinler ve antimikrobiyal peptidlerin üretimini engelleyerek bağırsak fonksiyonlarını düzensizleştirebilir ve başka enfeksiyonlara yol açabilir, hatta tekrarlayan enfeksiyon ataklarına neden olabilir. Amerikan Gastroenteroloji Derneği (AGA), antibiyotik kullanan bireylerde CD enfeksiyonunu önlemek için spesifik probiyotikleri şartlı olarak önermekte, ancak kanıt kalitesinin düşük olduğunu belirtmektedir [20].
Ortaya çıkan keşifler ve gelecekte ishal yönetimi
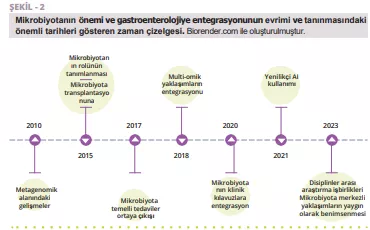
Metagenomik analiz ve mikrobiyal transplantasyon da dahil olmak üzere mikrobiyota araştırmasındaki son gelişmeler, ishal tedavisine yaklaşımımızı yeniden şekillendirmektedir (Şekil 2).
İshal için tedavi seçenekleri, sıvı akışını bozabilen bulaşıcı toksinlerden ishalin oluşumunda rol oynayan nedensel mekanizmaları dikkate almalıdır ve elektrolit dengesini, diğer nedenlere bağlı olarak disbiyoz gelişen hastalara ve yüksek miktarda emilmeyen Lümendeki karbonhidratlar ozmotik diyareyi tetikler.
İshal tedavisinde prebiyotikler ve liflerle ilgili sınırlı veri bulunmaktadır (tablo 2). Görünüşe göre, prebiyotikler ishalin tekrarını önlemeye ve tedavi etmeye daha yatkındır. Aynı zamanda, lifler, özellikle viskoz olanlar, sıvı tutma kapasiteleri nedeniyle akut ataklar sırasında daha fazla endikedir. Diğer tedavi seçenekleri arasında bazı vakalarda probiyotik uygulaması ve (tablo 3) bazı vakalarda fekal mikrobiyota transplantasyonu (FMT) kullanımı yer almaktadır.
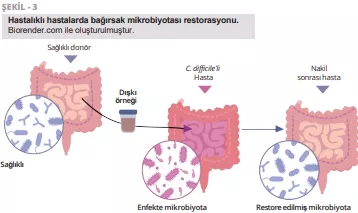
FMT'nin keşfinin büyüleyici yolculuğunun kökleri, Ge Hong'un dışkı süspansiyonundan oluşan bir "sarı çorba" kullanarak şiddetli ishali olan hastaları tedavi ettiği antik Çin'e dayanmaktadır. Modern zamanlarda, Dr. Ben Eiseman 1958 yılında psödomembranöz enterokolit tedavisinde sağlıklı bireylerden alınan dışkı lavmanlarını kullanmıştır. Günümüzde, tekrarlayan Clostridioides difficile enfeksiyonu (CDI) için bir tedavi olarak fekal mikrobiyota transplantasyonuna (FMT) artan bir ilgi vardır ve bu da faydasına işaret etmektedir [22]. İnflamatuar bağırsak hastalığı, diyabet, kanser, karaciğer sirozu ve Parkinson gibi beyin hastalıklarına yönelik etkinliği ile ilgili araştırmalar devam etmektedir [23]. İshalli hastalarda FMT kullanmanın faydaları, FMT yoluyla eklenen sağlıklı mikrobiyal floranın patojenleri alt etme ve sağlıklı bir bağırsak mikrobiyomunun bileşimini geri kazanma yeteneğine sahip olduğu fikrine dayanmaktadır (Şekil 3).


Sonuç
Araştırma, bağırsak mikrobiyota çeşitliliğinin azalmasının artan duyarlılıkla ilişkili olduğunu ortaya koyuyor ve potansiyel teşhis ve terapötik müdahalelerin önünü açmaktadır. Dengeli ve çeşitli bir bağırsak mikrobiyotasının korunması ishali önler ve genel sindirim sağlığını destekler. Disbiyoz olarak bilinen mikrobi-yotadaki dengesizlikler, bulaşıcı akut ishallerden kaynaklanabilir. kronik ishale katkıda bulunabilecek diğer faktörlere (sık antibiyotik kullanımı, sağlıksız beslenme, malabsorpsiyon) bağlı ishal veya disbiyoz. Mikrobiyal kompozisyon ve klinik semptomlar arasındaki karmaşık etkileşimin anlaşılması, ishalin kişiselleştirilmiş hasta yönetimi için çok önemlidir. Benzersiz mikrobiyota profillerine dayalı özel yaklaşımlar daha etkili stratejiler veya müdahaleler sağlayabilir. Probiyotiklerin ve prebiyotikler açısından zengin bir diyetin uygulanması, mikrobi-yota nakli, multi-omik yaklaşımların entegrasyonu, makine öğreniminin yenilikçi kullanımı ve disiplin-ler arası araştırma işbirliklerinin artan eğilimi, mikrobiyal dengenin yeniden sağlanmasına ve gastrointestinal refahın desteklenmesi-ne yardımcı olabilir. Umuyoruz ki Gelecekte, Peter J. Turnbaugh tarafından önerildiği gibi mikrobiyom temelli tedaviler tasarlanabilir ve yeni tedavi ilkelerinin temeli atılabilir [25].
1. Iancu MA, Profir M, Roşu OA, et al. Revisiting the Intestinal Microbiome and Its Role in Diarrhea and Constipation. Microorganisms 2023; 11: 2177.
2. David L, Weil A, Ryan ET, et al. Gut microbial succession follows acute secretory diarrhea in humans. mBio 2015; 6: 1-14.
3. Sohail MU, Al Khatib HA, Al Thani AA, et al. Microbiome profiling of rotavirus infected children suffering from acute gastroenteritis. Gut Pathog 2021; 13: 21.
4. Becker-Dreps S, Allali I, Monteagudo A, et al. Gut Microbiome Composition in Young Nicaraguan Children During Diarrhea Episodes and Recovery. Am J Trop Med Hyg 2015; 93: 1187-93.
5. Cannon JL, Seabolt MH, Xu R, et al. Gut Microbiome Changes Occurring with Norovirus Infection and Recovery in Infants Enrolled in a Longitudinal Birth Cohort in Leon, Nicaragua. Viruses 2022; 14: 1395.
6. Azagra-Boronat I, Massot-Cladera M, Knipping K, et al. Strain-Specific Probiotic Properties of Bifidobacteria and Lactobacilli for the Prevention of Diarrhea Caused by Rotavirus in a Preclinical Model. Nutrients 2020; 12: 498.
7. Kim AH, Lee Y, Kim E, et al. Assessment of oral vancomycin-induced alterations in gut bacterial microbiota and metabolome of healthy men. Front Cell Infect Microbiol 2021; 11: 629438.
8. Binder HJ. Role of colonic short-chain fatty acid transport in diarrhea. Annu Rev Physiol 2010; 72: 297-313.
9. Collinson S, Deans A, Padua-Zamora A, et al. Probiotics for treating acute infectious diarrhoea. Cochrane Database Syst Rev 2020; 12:CD003048.
10. Desselberger U. Viral gastroenteritis. Medicine 2017; 45: 690-4.
11. GBD 2016 Diarrheal Disease Collaborators. Estimates of the global, regional, and national morbidity, mortality, and aetiologies of diarrhea in 195 countries: a systematic analysis for the Global Burden of Disease Study 2016. Lancet Infect Dis 2018; 18: 1211-8.
12. Iturriza-Gómara M, Cunliffe NA. 34 - Viral Gastroenteritis. Ryan ET, Hill DR, Solomon T, Aronson NE, Endy TP. (eds) Hunter’s Tropical Medicine and Emerging Infectious Diseases (tenth edition). Elsevier, 2020, pp. 289-307.
13. Szajewska H, Berni Canani R, Domellöf M et al.; ESPGHAN Special Interest Group on Gut Microbiota and Modifications. Probiotics for the Management of Pediatric Gastrointestinal Disorders: Position Paper of the ESPGHAN Special Interest Group on Gut Microbiota and Modifications. J Pediatr Gastroenterol Nutr 2023; 76: 232-47.
14. Kopacz K, Phadtare S. Probiotics for the Prevention of antibiotic-associated diarrhea. Healthcare 2022; 10: 1450.
15. Fan H, Gao L, Yin Z, et al. Probiotics and rifaximin for the prevention of travelers’ diarrhea: A systematic review and network meta-analysis. Medicine 2022; 101: e30921.
16. Girardin M, Seidman EG. Indications for the use of probiotics in gastrointestinal diseases. Dig Dis 2011; 29: 574-87.
17. Goodman C, Keating G, Georgousopoulou E, et al. Probiotics for the prevention of antibiotic-associated diarrhoea: a systematic review and meta-analysis. BMJ Open 2021; 11: e043054.
18. McFarland LV. Antibiotic-associated diarrhea: epidemiology, trends and treatment. Future Microbiol 2008; 3: 563-78.
19. Barbut F, Meynard JL. Managing antibiotic associated diarrhoea. BMJ 2002; 324: 1345-6.
20. Su GL, Ko CW, Bercik P, et al. AGA Clinical Practice Guidelines on the Role of Probiotics in the Management of Gastrointestinal Disorders. Gastroenterology 2020; 159: 697-705.
21. Codex AC. Report of the 31th session of the codex committee on nutrition and foods for special dietary uses. Rome, Italy: FAO/WHO 2009.
22. Peery AF, Kelly CR, Kao D, et al.; AGA Clinical Guidelines Committee. AGA Clinical Practice Guideline on Fecal Microbiota-Based Therapies for Select Gastrointestinal Diseases. Gastroenterology 2024; 166: 409-34.
23. Tariq R, Disbrow MB, Dibaise JK, etal. Efficacy of Fecal Microbiota Transplantation for Recurrent C. Difficile Infection in Inflammatory Bowel Disease. Inflamm Bowel Dis 2020; 26: 1415-20.
24. Guarino A, Ashkenazi S, Gendrel D, et al. European Society for Pediatric Gastroenterology, Hepatology, and Nutrition/European Society for Pediatric Infectious Diseases evidence-based guidelines for the management of acute gastroenteritis in children in Europe: update 2014. J Pediatr Gastroenterol Nutr 2014; 59: 132-52.
25. Rock RR, Turnbaugh PJ. Forging the microbiome to help us live long and prosper. PLoS Biol 2023; 21: e3002087.

